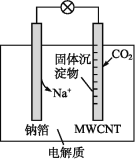
题目内容
【题目】T ℃时,A气体与B气体反应生成C气体,反应过程中A、B、C浓度变化如图(Ⅰ)所示,若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图(Ⅱ)所示。
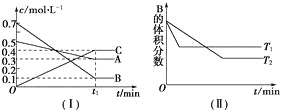
根据以上条件,回答下列问题:
(1)A与B反应生成C的化学方程式为_________________________,正反应为________(填“吸热”或“放热”)反应。
(2)在密闭容器中,加入2 mol A和6 mol B。
① 当反应达到平衡时,A和B的浓度比是_______;A和B的转化率之比是_______。
② 升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量________。(填“变大”、“变小”或“不变”)
③ 当达到平衡时,充入氩气,并保持压强不变,平衡将______(填“正向”、“逆向”或“不”)移动。
④ 若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将________(填“正向”、“ 逆向”或“不移动”)。达到新平衡后,容器内温度________(填“大于”、“小于”或“等于”)原来的2倍。
【答案】A(g)+3B(g)![]() 2C(g) 放热 1∶3 1∶1 变小 逆向 逆向 小于
2C(g) 放热 1∶3 1∶1 变小 逆向 逆向 小于
【解析】
(1)根据题中图1可知,反应过程中消耗的A、B和C的物质的量之比为(0.5-0.3):(0.7-0.1):0.4=0.2:0.6:0.4=1:3:2,该反应的化学方程式为A(g)+3B(g)![]() 2C(g);根据题中图Ⅱ知,T1时刻先达到平衡,反应速率快,因此T1>T2;而温度从T2变化到T1时,B的体积分数增大,平衡向逆方向移动,因此该反应是放热反应,ΔH<0;
2C(g);根据题中图Ⅱ知,T1时刻先达到平衡,反应速率快,因此T1>T2;而温度从T2变化到T1时,B的体积分数增大,平衡向逆方向移动,因此该反应是放热反应,ΔH<0;
(2)①加入2 mol A和6 mol B,加入的量之比=1:3,消耗的量之比等于系数之比=1:3所以达平衡后,A和B的浓度比也是1:3;加入的量之比=1:3,消耗的量之比等于系数之比=1:3所以转化率之比=1:1;
②升高平衡体系的温度,平衡逆向移动,质量不变,物质的量增大,所以混合气体的平均相对分子质量变小。
③当达到平衡时,充入氩气,并保持压强不变,体积变大浓度变小,平衡逆向移动;
④反应放热,升高温度平衡逆向移动;升温,平衡向吸热的逆向移动,使体系温度降低,容器内温度小于原来的2倍。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
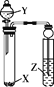
小学生10分钟应用题系列答案【题目】下列实验能达到相应实验目的的是
选 项 | 试剂 | 实验目的 | 实验装置 | ||
X | Y | Z | |||
A | Na2SO3 | 稀HNO3 | 品红溶液 | 证明SO2具有漂白性 |
|
B | MnO2 | 浓盐酸 | KI-淀粉溶液 | 比较Cl2与I2的氧化性强弱 | |
C | Na2CO3 | 醋酸 | Na2SiO3溶液 | 证明酸性: CH3COOH > H2CO3 >H2SiO3 | |
D | 蔗糖 | 浓硫酸 | 溴水 | 证明浓硫酸具有脱水性、氧化性 | |
A. AB. BC. CD. D
【题目】部分中学化学常见元素原子结构及性质如表所示
元素 | 结构及性质 |
A | A在第三周期中简单离子半径最小 |
B | B原子最外层电子数是内层电子数的 |
C | 使用最广泛的金属元素C能形成两种氯化物,其相对分子质量之差为35.5 |
D | D与B同主族,且通常状况下D没有正化合价 |
E | E在周期表中位于IA族,有人认为将其排在VIIA族也有一定道理 |
F | F与B同周期,其最高价氧化物的水化物与A或B的最高价氧化物的水化物均能反应 |
(1)C元素在周期表中的位置_____________;E形成的一种简单离子能支持“将E排在VIIA族”这一观点,该离子的结构示意图为_______________________。
(2)E与D可以按原子个数比2:1、1:1形成两种化合物X、Y,区别X、Y这两种物质的实验方法为________________________________。
E与B形成的一种化合物Z与X、Y中的一种电子总数相同且能发生化学反应,写出该反应的化学方程式__________________________(用相应化学式表示)
(3)请画出化合物F2B2的电子式__________,该化合物中含有的化学键类型是_______。
(4)将A、C的单质用导线连接后插入F的最高价氧化物的水化物溶液中可形成原电池,该原电池中阴离子移向_________(填“A”或“C”),写出该原电池总反应的离子方程式____________________。