题目内容
17.将100ml.0.1mol•L-1BaCl2涪液与100ml.0.2mol•L-1AICl3溶液混合,不考虑溶液混合时体积的变化,混合溶液中氯离子的浓度是( )| A. | 0.1 mol•L-l | B. | 0.2 mol•L-l | C. | 0.3 mol•L-l | D. | 0.4 mol•L-l |
分析 分别根据n=cV计算出该氯化钡溶液、氯化铝溶液中氯离子的物质的量,从而得出混合液中氯离子的总物质的量,最后根据c=$\frac{n}{V}$计算出混合液中氯离子的浓度.
解答 解:100ml.0.1mol•L-1BaCl2溶液中含有氯离子的物质的量为:0.1mol/L×2×0.1L=0.02mol,
100ml.0.2mol•L-1AlCl3溶液中含有氯离子的物质的量为:0.2mol/L×3×0.1L=0.06mol,
则混合液中含有氯离子的总物质的量为:0.02mol+0.06mol=0.08mol,
所以混合液中氯离子的物质的量浓度为:$\frac{0.08mol}{0.1L+0.1L}$=0.4mol/L,
故选D.
点评 本题考查了物质的量浓度的计算,题目难度中等,明确物质的量浓度的表达式为解答关键,试题侧重基础知识的考查,培养了学生的分析能力及化学计算能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
8. T℃时,将一定量的混合气体在密闭容器中发生反应aA(g)+bB(g)?cC(g)+dD(g),平衡后测得B气体的浓度为0.6mol/L,恒温下,将密闭容器中的容积扩大1倍,重新达到平衡后,测得B气体的浓度为0.4mol/L,下列叙述正确的是( )
T℃时,将一定量的混合气体在密闭容器中发生反应aA(g)+bB(g)?cC(g)+dD(g),平衡后测得B气体的浓度为0.6mol/L,恒温下,将密闭容器中的容积扩大1倍,重新达到平衡后,测得B气体的浓度为0.4mol/L,下列叙述正确的是( )
 T℃时,将一定量的混合气体在密闭容器中发生反应aA(g)+bB(g)?cC(g)+dD(g),平衡后测得B气体的浓度为0.6mol/L,恒温下,将密闭容器中的容积扩大1倍,重新达到平衡后,测得B气体的浓度为0.4mol/L,下列叙述正确的是( )
T℃时,将一定量的混合气体在密闭容器中发生反应aA(g)+bB(g)?cC(g)+dD(g),平衡后测得B气体的浓度为0.6mol/L,恒温下,将密闭容器中的容积扩大1倍,重新达到平衡后,测得B气体的浓度为0.4mol/L,下列叙述正确的是( )| A. | 重新达到平衡时,D的体积分数减小 | B. | a+b<c+d | ||
| C. | 平衡向右移动 | D. | 重新达到平衡时,A气体浓度增大 |
5.银锌电池广泛用作各种电子仪器的电源,其电极分别为Ag2O、Zn,电解质溶液为KOH溶液,总反应为Ag2O+Zn+H2O═2Ag+Zn(OH)2.下列说法中错误的是( )
| A. | 原电池放电时,负极上发生反应的物质是Zn | |
| B. | 负极上发生的反应是Zn+2OH--2e-═Zn(OH)2 | |
| C. | 工作时,负极区溶液pH减小,正极区pH增大 | |
| D. | 溶液中OH-向正极移动,K+、H+向负极移动 |
2.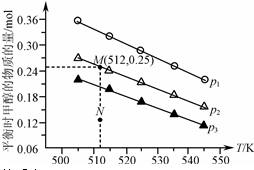 在1.0L恒容密闭容器中投入1mol CO2和2.75mol H2发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图所示.下列说法不正确的是( )
在1.0L恒容密闭容器中投入1mol CO2和2.75mol H2发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图所示.下列说法不正确的是( )
 在1.0L恒容密闭容器中投入1mol CO2和2.75mol H2发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图所示.下列说法不正确的是( )
在1.0L恒容密闭容器中投入1mol CO2和2.75mol H2发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图所示.下列说法不正确的是( )| A. | 该反应的正反应为放热反应 | |
| B. | 压强大小关系为p1<p2<p3 | |
| C. | M点对应的平衡常数K的值约为1.04×10-2 | |
| D. | 在p2及512K时,图中N点v(正)<v(逆) |
6.能正确表示下列化学反应的离子方程式的是( )
| A. | 氢氧化钡溶液与稀硫酸的反应 OH-+H+═H2O | |
| B. | 氧化钙与稀盐酸反应 CaO+2H+═Ca2++H2O | |
| C. | 铁片插入硝酸银溶液中 Fe+Ag+═Fe2++Ag | |
| D. | 碳酸钙溶于稀硝酸中 CO32-+2H+═CO2↑+H2O |
7.下列工业生产的主要反应中,涉及置换反应的是( )
| A. | 生产粗硅 | B. | 海水提镁 | C. | 电解冶铝 | D. | 生产硫酸 |
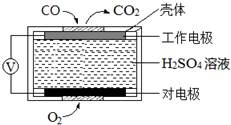 碳氧化物、氮氧化物、二氧化硫的处理与利用是世界各国研究的热点问题.
碳氧化物、氮氧化物、二氧化硫的处理与利用是世界各国研究的热点问题.