题目内容
8. T℃时,将一定量的混合气体在密闭容器中发生反应aA(g)+bB(g)?cC(g)+dD(g),平衡后测得B气体的浓度为0.6mol/L,恒温下,将密闭容器中的容积扩大1倍,重新达到平衡后,测得B气体的浓度为0.4mol/L,下列叙述正确的是( )
T℃时,将一定量的混合气体在密闭容器中发生反应aA(g)+bB(g)?cC(g)+dD(g),平衡后测得B气体的浓度为0.6mol/L,恒温下,将密闭容器中的容积扩大1倍,重新达到平衡后,测得B气体的浓度为0.4mol/L,下列叙述正确的是( )| A. | 重新达到平衡时,D的体积分数减小 | B. | a+b<c+d | ||
| C. | 平衡向右移动 | D. | 重新达到平衡时,A气体浓度增大 |
分析 保持温度不变,将容器的体积扩大1倍,如平衡不移动,B气体的浓度为0.3mol/L,小于实际B的浓度变为0.4mol/L,说明平衡向生成B的方向移动,即向逆反应移动,据此结合选项解答.
解答 解:保持温度不变,将容器的体积扩大1倍,如平衡不移动,B气体的浓度为0.3mol/L,小于实际B的浓度变为0.4mol/L,说明平衡向生成B的方向移动,即向逆反应移动.
A、平衡向逆反应移动,D的体积分数减小,故A正确;
B、增大体积,压强减小,平衡向逆反应移动,压强减小平衡向气体物质的量增大的方向移动,即a+b>c+d,故B错误;
C、依据分析判断,化学平衡逆向进行,故C错误;
D、体积加倍,各物质的浓度都要减小,即A气体浓度减小,故D错误;
故选:A.
点评 本题考查化学平衡移动,体积变化和平衡移动都可以引起浓度变化,难度中等,利用假设法判断平衡移动方向是解题关键.

练习册系列答案
 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
ABC考王全优卷系列答案
相关题目
19.下列关于溶液说法不正确的是( )
| A. | 常温下,浓度均为0.2mol•L-1的NaHCO3和Na2CO3溶液中,都存在电离平衡和水解平衡,分别加入NaOH固体恢复到原来的温度,c(CO32- )均增大 | |
| B. | 已知乙酸(HA)的酸性比甲酸(HB)弱,在物质的量浓度均为0.1 mol•L-1的NaA和NaB混合溶液中,c(Na+)>c(B-)>c(A-)>c( OH-)>c(HA)>c(HB)>c(H+) | |
| C. | pH相同的CH3COONa溶液、C6H5ONa溶液、Na2CO3溶液、NaOH溶液,其浓度:c(CH3COONa)>c(C6H5ONa)>c( Na2CO3)>c(NaOH) | |
| D. | 一定温度下,pH相同的溶液,由水电离产生的c(H+)相同 |
19.我国是个钢铁大国,钢铁产量为世界第一,高炉炼铁是最为普遍的炼铁方法.
I.已知反应Fe2O3(s)+CO(g)?Fe(s)+CO2(g)△H=-23.5kJ•mol-1,该反应在1000℃的平衡常数等于4.在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,应经过l0min后达到平衡.
(1)CO的平衡转化率=60%
(2)欲提高CO的平衡转化率,促进Fe2O3的转化,可采取的措施是d.
a.提高反应温度
b.增大反应体系的压强
c.选取合适的催化剂
d.及时吸收或移出部分CO2
e.粉碎矿石,使其与平衡混合气体充分接触
Ⅱ.高炉炼铁产生的废气中的CO可进行回收,使其在一定条件下和H2反应制备甲醇:CO(g)+2H2(g)?CH3OH(g).请根据图示回答下列问题:
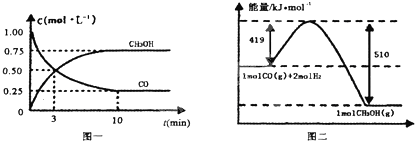
(3)从反应开始到平衡,用H2浓度变化表示平均反应速率v(H2)=0.15mol/(L•min).
(4)已知氢气的燃烧热286kJ/mol,请写出甲醇气体不充分燃烧的热化学方程式CH3OH(g)+O2(g)=2H2O(l)+CO(g)△H=-481kJ/mol.
(5)若在温度和容器相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡吋的有关数据如下表:
则下列关系正确的是ADE
A.c1=c2B.2Q1=Q3C.2α1=α3D.α1+α2=1E.该反应若生成1mol CH3OH,则放出(Q1+Q2)kJ热量
Ⅲ.以甲烷为燃料的新型电池,其成本大大低于以氢为燃料的传统燃料电池,目前得到广泛的研究,如图是目前研究较多的一类固体氧化物燃料电池工作原理示意图.回答下列问题:

(6)B极上的电极反应式为CH4-8e-+4O2-=CO2+2H2O.
(7)若用该燃料电池做电源,用石墨做电极电解100mL 1mol/L的硫酸铜溶液,当两极收集到的气体体积相等时,理论上消耗的甲烷的体积为1.12L(标况下).
I.已知反应Fe2O3(s)+CO(g)?Fe(s)+CO2(g)△H=-23.5kJ•mol-1,该反应在1000℃的平衡常数等于4.在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,应经过l0min后达到平衡.
(1)CO的平衡转化率=60%
(2)欲提高CO的平衡转化率,促进Fe2O3的转化,可采取的措施是d.
a.提高反应温度
b.增大反应体系的压强
c.选取合适的催化剂
d.及时吸收或移出部分CO2
e.粉碎矿石,使其与平衡混合气体充分接触
Ⅱ.高炉炼铁产生的废气中的CO可进行回收,使其在一定条件下和H2反应制备甲醇:CO(g)+2H2(g)?CH3OH(g).请根据图示回答下列问题:

(3)从反应开始到平衡,用H2浓度变化表示平均反应速率v(H2)=0.15mol/(L•min).
(4)已知氢气的燃烧热286kJ/mol,请写出甲醇气体不充分燃烧的热化学方程式CH3OH(g)+O2(g)=2H2O(l)+CO(g)△H=-481kJ/mol.
(5)若在温度和容器相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡吋的有关数据如下表:
| 容器 | 反应物投入的量 | 反应物的 转化率 | CH3OH的浓度 | 能量变化 (Q1、Q2、Q3均大于0) |
| 甲 | 1mol CO和2mol H2 | α1 | c1 | 放出Q1kJ热量 |
| 乙 | 1mol CH3OH | α2 | c2 | 吸收Q2kJ热量 |
| 丙 | 2mol CO和4mol H2 | α3 | c3 | 放出Q3kJ热量 |
A.c1=c2B.2Q1=Q3C.2α1=α3D.α1+α2=1E.该反应若生成1mol CH3OH,则放出(Q1+Q2)kJ热量
Ⅲ.以甲烷为燃料的新型电池,其成本大大低于以氢为燃料的传统燃料电池,目前得到广泛的研究,如图是目前研究较多的一类固体氧化物燃料电池工作原理示意图.回答下列问题:

(6)B极上的电极反应式为CH4-8e-+4O2-=CO2+2H2O.
(7)若用该燃料电池做电源,用石墨做电极电解100mL 1mol/L的硫酸铜溶液,当两极收集到的气体体积相等时,理论上消耗的甲烷的体积为1.12L(标况下).
3.在一个密闭容器中放入X、Y、Z、Q四种物质,在一定条件下发生化学反应,一段时间后,测得有关数据如表,则关于此反应认识错误的是( )
| 物质 | X | Y | Z | Q |
| 反应前质量(g) | 20 | 2 | 1 | 37 |
| 反应后质量(g) | 未测 | 32 | 1 | 12 |
| A. | 物质Z可能是该反应的催化剂 | B. | 反应后物质X的质量为15g | ||
| C. | 反应中Y、Q的质量比为6:5 | D. | 物质Y一定是单质 |
17.将100ml.0.1mol•L-1BaCl2涪液与100ml.0.2mol•L-1AICl3溶液混合,不考虑溶液混合时体积的变化,混合溶液中氯离子的浓度是( )
| A. | 0.1 mol•L-l | B. | 0.2 mol•L-l | C. | 0.3 mol•L-l | D. | 0.4 mol•L-l |
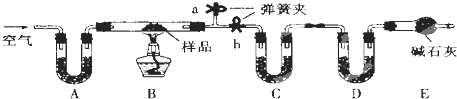
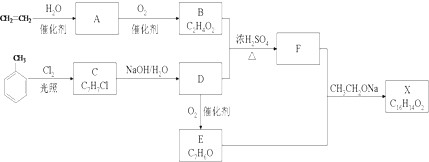
 .
.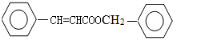 .
.