题目内容
常温下,对下列四种溶液的叙述正确的是
| | ① | ② | ③ | ④ |
| pH | 12 | 12 | 2 | 2 |
| 溶液 | 氨水 | 氢氧化钠溶液 | 醋酸溶液 | 盐酸 |
A.③、④两溶液相比,两者的KW相同
B.①、②两种溶液分别加水稀释100倍,pH变化较大的是①
C.等体积的③、④溶液中分别加入过量锌粒,产生的氢气前者大于后者
D.①、④ 两溶液按2: 1体积比混合后溶液中微粒浓度满足c(NH4+)+c(NH3·H2O)=c(Cl-)
AC
解析试题分析:A、KW只受温度影响,正确;B、加水稀释促进弱碱氨水的电离,所以pH变化较大的是NaOH溶液,错误;C、醋酸为弱酸,浓度远远大于盐酸,加入过量锌粒,产生氢气多,正确;D、氨水浓度远远大于盐酸,c(NH4+)+c(NH3·H2O)>c(Cl-),错误。
考点:本题考查溶液的pH、弱电解质的电离。

练习册系列答案
相关题目
25℃时,a mol·L-1一元酸HA溶液与b mol·L-1NaOH溶液等体积混合后,pH为7,则下列关系一定正确的是
| A.a=b | B.a>b | C.c(A-)= c(Na+) | D.c (A-)< c(Na+) |
图示化学变化的类型属于
| A.取代 | B.水解 | C.中和 | D.电离 |
向NaOH(aq)滴入HAc(aq)的过程中,溶液中离子浓度的大小可能正确的是
| A.c(OH-) = c(Na+) > c(Ac-) > c(H+) | B.c(Na+) > c(OH-) = c(Ac-) > c(H+) |
| C.c(Na+) > c(Ac-) > c(OH-) > c(H+) | D.c(H+) > c(Ac-) > c(Na+) > c(OH-) |
现有室温下四种溶液,有关叙述不正确的是
| 编号 | ① | ② | ③ | ④ |
| pH | 11 | 11 | 3 | 3 |
| 溶液 | 氨水 | 氢氧化钠溶液 | 醋酸溶液 | 盐酸 |
A.相同体积③、④溶液分别与NaOH完全反应,消耗NaOH物质的量:③>④
B.分别加水稀释10倍,四种溶液的pH ①>②>④>③
C.①、④两溶液等体积混合,所得溶液中c(Cl-)>c(NH4+)>c(OH-)>c(H+)
D.Va L ④溶液与Vb L ②溶液混合(近似认为混合溶液体积=Va + Vb),若混合后溶液
pH = 4,则Va : Vb =" 11" : 9
碳酸有两个电离常数Ki1、Ki2,分别对应碳酸的两步电离。关于Ki1和Ki2说法正确的是
A.Ki1的表达式为 |
B.Ki2对应的电离过程是HCO3— + H2O 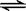 H3O+ + CO32— H3O+ + CO32— |
| C.当碳酸的电离平衡正向移动时,Ki1与Ki2均相应增大 |
| D.改变条件使Ki1减小,则Ki2一定也减小 |
下列实验方案不可行或结论不正确的是
| A.用润湿的pH试纸测定饱和Na2CO3溶液pH |
B.通过观察图中导管水柱的变化,验证铁钉生锈的原因主要是吸氧腐蚀 |
| C.向Mg(OH)2悬浊液中滴加FeCl3溶液,出现红褐色沉淀,说明溶解度:Fe(OH)3<Mg(OH)2 |
| D.向同pH、同体积的醋酸和盐酸溶液中加入足量镁粉,通过完全反应后收集到的H2体积比较两种酸的电离程度:醋酸<盐酸 |
常温下,用Na2SO3溶液吸收SO2时,溶液pH随n(SO32-):n(HSO3-)变化的关系如下表:
| n(SO32-):n(HSO3-) | 91:1 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
以下离子浓度关系的判断正确的是
A.NaHSO3溶液中c(H+)<c(OH-)
B.Na2SO3溶液中c(Na+)>c(SO32-)>c(HSO3-)>c(OH-)>c(H+)
C.当吸收液呈中性时,c(Na+)>c(SO32-)>c(HSO3-)>c(OH-)=c(H+)
D.当吸收液呈中性时,c(Na+)= c(HSO3-)+2 c(SO32-)
己知H2CO3的酸性强于H2S,将amol·L -1 NaHS与bmol·L-1NaOH两种稀溶液等体积混合(a>0,b>0),所得溶液中微粒间的物质的量浓度关系正确的是
| A.a=b时:c(OH-)= c(H+)+c(HS-) |
| B.a=2b时:c(S2-)>c(HS )>c(OH-)>c(H+) |
| C.a=3b时:c(Na+)+c(H+)=2c(S2-)+c(HS-)+c(OH-) |
| D.a=4b时:4c(Na+)=5c(S2-)+5c(HS-)5c(H2S) |