题目内容
把19.2 g 的Cu放入足量的稀硝酸中,微热至Cu完全反应。
已知:3Cu + 8HNO3(稀) = 3Cu(NO3)2 +2NO↑+ 4H2O求:
(1)参加反应的硝酸的物质的量;
(2)被还原的硝酸的质量;
(3)生成的NO在标准状况下的体积。
(1)0.8mol (2)12.6g (3)4.48L
解析试题分析:19.2g 的Cu的物质的量为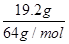 =0.3mol,
=0.3mol,
(1)设参加反应的硝酸的物质的量为x
3Cu+8HNO3(稀)=3Cu(NO3)2 +2NO↑+4H2O
3mol 8mol
0.3mol x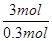 =
=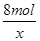
x=0.8mol,
答案:参加反应的硝酸的物质的量为0.8mol.
(2)由方程式可以看出,硝酸没有全部被还原,当有8mol硝酸反应时,有2mol被还原,
则0.8mol硝酸参加反应,被还原的硝酸的物质的量为0.2mol,质量为:0.2mol×63g·mol-1=12.6g.答案:12.6g;
(3)设产生的NO在标准状况下的体积为V,则
3Cu+8HNO3(稀)=3Cu(NO3)2 +2NO↑+4H2O
3mol 44.8L
0.3mol V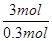 =
=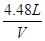
V=4.48L,
答案:产生的NO在标准状况下的体积为4.48L
考点:化学方程式的有关计算

水是组成生命体的重要物质,有关水的反应实例有很多。
(1)有人设想将太阳能转化为电能,进而将水电解生成氢气,氢气是一种清洁能源。请分析电解水的过程中,水是_____________(填仅被氧化,仅被还原,既被氧化又被还原,既不被氧化又不被还原)
(2)野营爱好者携带氢化钙固体作为生氢剂,方程式为CaH2+2H2O=Ca(OH)2+2H2↑,其中水是_____________(填仅被氧化,仅被还原,既被氧化又被还原,既不被氧化又不被还原)
(3)在下列反应中水只被还原的是_____________(填序号)
| A.C+H2O=CO+H2 | B.CaO+H2O=Ca(OH)2 |
| C.3Fe+4H2O=Fe3O4+4H2 | D.3NO2+H2O=2HNO3+NO |
3NO2+H2O=2HNO3+NO
25℃、101kPa下:①2Na(s)+1/2O2(g)=Na2O(s) △H1=-414kJ·mol-1
②2Na(s)+O2(g)=Na2O2(s) △H2=-511kJ·mol-1
下列说法正确的是( )
| A.①和②产物的阴阳离子个数比不相等 |
| B.①和②生成等物质的量的产物,转移电子数不同 |
| C.常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快 |
| D.25℃、101kPa下,Na2O2(s)+2Na(s)=2Na2O(s) △H=-317kJ·mol-1 |
 AlN+3HCl反应中,该方法比前者在生产上更具优势。下列说法中,正确的是 。
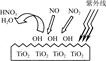
AlN+3HCl反应中,该方法比前者在生产上更具优势。下列说法中,正确的是 。 HNO3。写出OH与NO反应的化学方程式:_____________,该反应中被氧化的元素是 。
HNO3。写出OH与NO反应的化学方程式:_____________,该反应中被氧化的元素是 。