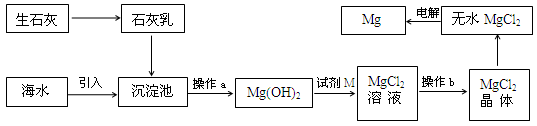
题目内容
将25.6g铜与含0.3molH2SO4的浓硫酸充分反应,(1)若在反应过程中消耗了0.2mol的H2SO4,则生成的气体标况下体积为多少?(2)若以上反应产生的气体全部逸出后,继续在剩余物质中加入2mol/L的稀硝酸100ml,充分反应后产生NO的物质的量为多少?
(1)2.24L (2)0.1mol
解析试题分析:(1)铜与浓硫酸反应产生的气体为二氧化硫气体,Cu+2H2SO4 CuSO4+SO2↑+2H2O,被还原的硫酸占参加反应的硫酸的一半,所以消耗0.2mol硫酸有0.1mol的硫酸被还原,则有0.1mol的二氧化硫生成,所以生成气体的体积为标准状况下2.24L
CuSO4+SO2↑+2H2O,被还原的硫酸占参加反应的硫酸的一半,所以消耗0.2mol硫酸有0.1mol的硫酸被还原,则有0.1mol的二氧化硫生成,所以生成气体的体积为标准状况下2.24L
(2)由(1)知硫酸耗用铜0.1mol,质量为6.4g,余19.2g铜,余0.1mol H2SO4,加入2mol/L的稀硝酸100ml此时溶液中n(H+)=0.2+0.2=0.4mol,n(NO3-)=0.2mol,n(Cu)=0.3mol,铜与稀硝酸反应的离子方程式为
3Cu+8H++2 NO3-= 3Cu2++2NO↑+4 H2O,所以H+不足,按H+计算,因此生成NO的物质的量为0.1mol。
考点:考查铜与浓硫酸、稀硝酸反应的计算

碘化亚铜(Cu2I2)是一种不溶于水也不溶于酸的白色固体,用途很广泛。
完成下列填空:
(1)碘化钾溶液中滴加适量硫酸铜溶液,就能得到碘化亚铜。请完成并配平上述反应:
____KI+____CuSO4 → ____I2+____Cu2I2↓+ ____________
该反应中氧化剂与还原剂的物质的量之比为___________。
(2)往上述反应后溶液中加入淀粉,溶液变蓝,再滴加亚硫酸溶液,蓝色又褪去。
写出KI、Cu2I2、H2SO3的还原性由强到弱的顺序是____________________。
(3)碘化亚铜能用于检测空气中的汞蒸气,其反应为:
2Cu2I2+Hg → Cu2HgI4(玫瑰红)+ 2Cu
产物Cu2HgI4中,Cu元素显____价。
当有1 molCu2I2参与反应时,转移电子____mol。
(4)为除去稀盐酸中少量CuCl2杂质,可往溶液中加入过量的M试剂后进行过滤操作,再通入适量的Cl2后进行N操作。试剂M和操作N的组合正确的是_____(选填编号)
| 选项 | 试剂M | 操作N |
| a | 碘化钾溶液 | 升华 |
| b | 氢碘酸溶液 | 萃取分液 |
| c | 氢气 | 过滤 |
| d | 氢硫酸溶液 | 过滤 |
“低碳循环”引起世界各国的高度关注,而如何降低大气中CO2的含量及有效地开发利用CO2,更是引起了全世界的普遍重视。
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请配平该反应的化学方程式:(将化学计量数按顺序填在答题卷上)
___C+____KMnO4+____H2SO4→___CO2↑+____MnSO4+____K2SO4+___H2O
(2)将不同最的CO(g)和H2O(g)分别通人到容积为2L的恒容密闭容器中,进行如下反应:
CO(g)+H2O(g) CO2(g)+H2(g) 得到表中三组数据
CO2(g)+H2(g) 得到表中三组数据
| 实验 | 温度℃ | 起始量/mol | 平均量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
①实验1中以v (CO2)表示的反应速率为____(取二位小数,下同)。
②实验3条件下,反应物和生成物的起始量、平衡量都不知道,欲计算该条件下的化学平衡常数可以利用实验____的数据进行,其K=____。
(3)已知在常温常压下:
①2CH3OH(I)+3O2(g)=2CO2(g)+4H2O(g) △H=-1275.6kJ/mol
②2CO(g)+O2(g)=2CO(g) △H=-566.0kJ/mol
③H2O(g)=H2O(I) △H=-44.0kJ/mol
写出甲醇(CH2OH)不宪全燃烧生成一氧化碳和液态水的热化学方程式_ 。
(14分)2013年6月,我国“蛟龙”号再次刷新“中国深度”——下潜7062米,为我国深海矿物资源的开发奠定了基础。海洋深处有丰富的锰结核矿,锰结核的主要成分是MnO2,同时还含有黄铜矿。
Ⅰ、“蛟龙”号外壳是用特殊的钛合金材料制成,它可以在7000m的深海中承受重压,Ti是以钛白粉(TiO2)为原料进行生产,钛白粉是利用TiO2+发生水解生成钛酸(H2TiO3)沉淀,再煅烧沉淀制得的。TiO2+发生水解的离子方程式为____________________________。
Ⅱ、MnO2是一种重要的无机功能材料,工业上从锰结核中制取纯净的MnO2工艺流程如下图所示: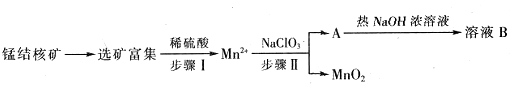
(1)步骤Ⅱ中以NaClO3为氧化剂,当生成0.05molMnO2时,消耗0.1mol/L的NaClO3溶液200ml,该反应离子方程式为_______________________________。
(2)已知溶液B的溶质之一可循环用于上述生产,此物质的名称是____________。
Ⅲ、利用黄铜矿炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3等)可制备Fe2O3,方法为:
(A)用过量的稀盐酸浸取炉渣、过滤;(B)向滤液中加入5%的H2O2,再向其中加入过量的NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得到Fe2O3。根据以上信息回答下列问题:
(1)(B)中向滤液中加入5%的H2O2,其目的是_________________________________。
(2)设计实验证明炉渣中含有FeO___________________________________________。
(3)将煅烧得到的Fe2O3还原为Fe单质,再将质量为m g的Fe单质分成相等的四份,分别与50mL、100mL、150mL、200mL的等浓度的稀硝酸反应,反应产物NO在标况下的体积见附表:
| 实验 | ① | ② | ③ | ④ |
| V(HNO3)/ml | 50 | 100 | 150 | 200 |
| V(NO)/L | 1.344 | 2.688 | 3.36 | 3.36 |
②写出实验②发生反应的化学方程式:_____________________________。
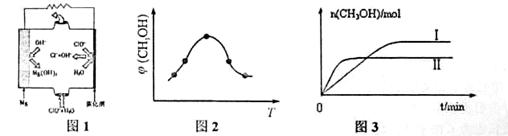
 CH3OH(g)+H2O(g) ΔH
CH3OH(g)+H2O(g) ΔH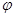 (CH3OH)与反应温度T的关系曲线如图2所示,则上述CO2转化为甲醇反应的 ΔH_____0 (填“>”、“<”或“ =” )。
(CH3OH)与反应温度T的关系曲线如图2所示,则上述CO2转化为甲醇反应的 ΔH_____0 (填“>”、“<”或“ =” )。