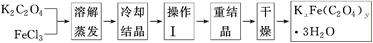
题目内容
铁及其化合物之间的相互转化可用下式表示: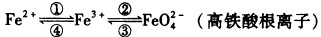
回答下列有关问题:
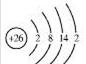
(1)铁元素位于元素周期表的第四周期第Ⅷ族,原子序数是26,最外层有2个电子。元素铁的原子结构示意图是 。
(2)检验硫酸铁溶液中是否存在Fe2+的方法是
(3)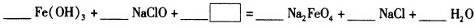
(4)高铁酸钠(Na2FeO4)是水处理过程中使用的一种新型净水剂,它的氧化性比高锰酸钾强,其本身在反应中被还原为Fe3+。Na2FeO4之所以能净水,除了能消毒杀菌外,另一个原因是(结合离子方程式说明) 。
(1) ;
;
(2)将适量硫酸铁溶液置于洁净试管中,滴加几滴酸性高锰酸钾溶液,充分反应后,溶液紫色褪去,证明含有Fe2+,否则不含Fe2+;
(3)2Fe(OH)3+3NaClO+4NaOH=2Na2FeO4+3NaCl+5H2O;(4)Fe3++3H2O=Fe(OH)3(胶体)+3H+,氢氧化铁胶体吸附水中悬浮的杂质。
解析试题分析:(1)铁元素位于元素周期表的第四周期第Ⅷ族,原子序数是26,最外层有2个电子,根据原子核外电子排布规律知,元素铁的原子结构示意图是 ;(2)检验硫酸铁溶液中是否存在Fe2+,为防止铁离子的干扰应利用亚铁离子的还原性检验,方法是将适量硫酸铁溶液置于洁净试管中,滴加几滴酸性高锰酸钾溶液,充分反应后,溶液紫色褪去,证明含有Fe2+,否则不含Fe2+;(3)利用化合价升降法配平氧化还原方程式得2Fe(OH)3+3NaClO+4NaOH=2Na2FeO4+3NaCl+5H2O;(4)高铁酸钠(Na2FeO4)是水处理过程中使用的一种新型净水剂,它的氧化性比高锰酸钾强,其本身在反应中被还原为Fe3+。Na2FeO4之所以能净水,除了能消毒杀菌外,另一个原因是Fe3++3H2O=Fe(OH)3(胶体)+3H+,氢氧化铁胶体吸附水中悬浮的杂质。
;(2)检验硫酸铁溶液中是否存在Fe2+,为防止铁离子的干扰应利用亚铁离子的还原性检验,方法是将适量硫酸铁溶液置于洁净试管中,滴加几滴酸性高锰酸钾溶液,充分反应后,溶液紫色褪去,证明含有Fe2+,否则不含Fe2+;(3)利用化合价升降法配平氧化还原方程式得2Fe(OH)3+3NaClO+4NaOH=2Na2FeO4+3NaCl+5H2O;(4)高铁酸钠(Na2FeO4)是水处理过程中使用的一种新型净水剂,它的氧化性比高锰酸钾强,其本身在反应中被还原为Fe3+。Na2FeO4之所以能净水,除了能消毒杀菌外,另一个原因是Fe3++3H2O=Fe(OH)3(胶体)+3H+,氢氧化铁胶体吸附水中悬浮的杂质。
考点:考查铁元素单质及其化合物的性质、氧化还原方程式的配平、盐类水解的应用。

 阅读快车系列答案
阅读快车系列答案利用化学原理对工厂排放的废水、废渣等进行有效检测与合理处理。
(一)染料工业排放的废水中含有大量有毒的NO2-,可以在碱性条件下加入铝粉除去(加热处理后的废水会产生能使湿润的红色石蕊试纸变蓝的气体)。除去NO2-的离子方程式为________。
(二)某工厂对制革工业污泥中Cr(Ⅲ)回收与再利用工艺如下(硫酸浸取液中金属离子主要是Cr3+,其次是Fe3+、Fe2+、Al3+、Ca2+、Mg2+):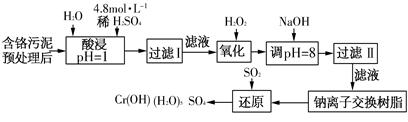
常温下部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cu2+ | Cr3+ |
| 开始沉淀 时的pH | 1.9 | 7.0 | — | — | 4.7 | — |
| 沉淀完全 时的pH | 3.2 | 9.0 | 11.1 | 8 | 6.7 | 9(>9溶解) |
(1)酸浸时,为了提高浸取率可采取的措施是________(至少写一条)。
(2)调pH=8是为了除去________(填Fe3+、Al3+、Ca2+、Mg2+)。
(3)钠离子交换树脂的原理为Mn++nNaR→MRn+nNa+,被交换的杂质离子是________(填Fe3+、Al3+、Ca2+、Mg2+)。
(4)试配平氧化还原反应方程式:□Na2Cr2O7+□SO2+□H2O = □Cr(OH)(H2O)5SO4+□Na2SO4;每生成1mol Cr(OH)(H2O)5SO4消耗SO2的物质的量为________。
(三)印刷电路铜板腐蚀剂常用FeCl3。腐蚀铜板后的混合浊液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10mol·L-1,请参照上表给出的数据和提供的药品,简述除去CuCl2溶液中Fe3+和Fe2+的实验步骤:①________;②________;③过滤。(提供的药品:Cl2、浓H2SO4、NaOH溶液、CuO、Cu)。
(14分)Ⅰ.某同学做“铝热反应”的实验。查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2980 | 2750 | —— |
(2)下列能与Al发生铝热反应的有 。(填序号)
A、MnO2 B、Na2O C、MgO D、FeO
(3)据上表数据该同学推测,铝热反应所得到的熔融物应是铁铝合金。若证明上述所得的块状熔融物中含有金属铝,所用试剂是 。
Ⅱ.某同学为了验证海带中含有碘,拟进行如下实验,请回答相关问题。
(1)第1步:灼烧。操作是将足量海带灼烧成灰烬。该过程中将使用到的实验仪器有________等。(填代号,下同)
A 试管 B 坩埚 C 烧杯 D 三角架
E、泥三角 F、洒精灯 G、铁架台 H、量筒
第2步:Iˉ溶液的获取。操作是将灰烬转移到烧杯中,加适量蒸馏水溶解,该过程为加快溶解可以采取哪些措施 。此操作后的分离方法________。(填分离方法)
(3)第3步:氧化。取(2)中溶液少量依次加入合适的试剂。下列氧化剂最好选_________。
A、浓硫酸 B、新制氯水 C、KMnO4溶液 D、H2O2
(4)第4步:碘单质的检验。操作是取少量第3步的溶液,滴加_______溶液,证明海带中含碘。