题目内容
(12分)根据下列某些短周期元素中元素性质回答问题。
(1)元素③、⑥和⑨的氢化物中沸点由高到低的顺序是__________ (填化学式)。
(2)元素①和⑨形成阳离子 ,其结构式为__________________。
(3)某元素R的原子半径为1.02×10 -10m ,它与钠形成Na2R2,其电子式是_________(R用元素符号表示)。
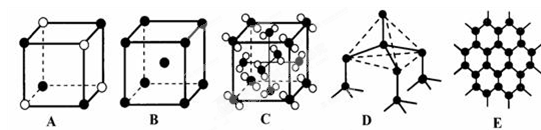
(4)元素②和⑦形成晶体的部分结构可用下图中的_________来表示(填序号)。
(5)①、③、⑨可以形成原子个数之比为4:3:2的中学常见无机化合物,该化合的水溶液显酸性的原因是_________________(用离子方程式表示),其水溶液中离子浓度由大到小的顺序是___________________。
| | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
| 原子半径/10 -10m | 0.37 | 1.86 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.52 | 0.75 | 0.71 |
| 最高价态 | +1 | +1 | | +3 | +4 | +5 | +7 | +1 | +5 | |
| 最低价态 | -1 | | -2 | | -4 | -3 | -1 | | -3 | -1 |
(2)元素①和⑨形成阳离子 ,其结构式为__________________。
(3)某元素R的原子半径为1.02×10 -10m ,它与钠形成Na2R2,其电子式是_________(R用元素符号表示)。
(4)元素②和⑦形成晶体的部分结构可用下图中的_________来表示(填序号)。

(5)①、③、⑨可以形成原子个数之比为4:3:2的中学常见无机化合物,该化合的水溶液显酸性的原因是_________________(用离子方程式表示),其水溶液中离子浓度由大到小的顺序是___________________。
(1)H2O、NH3、PH3; (2)  (3)
(3) (4) A
(4) A
(5) NH4+ + H2O NH3.H2O + H+ ; C(NO3--) > C(NH4+) > C( H+) > C(O H--)
NH3.H2O + H+ ; C(NO3--) > C(NH4+) > C( H+) > C(O H--)
 (3)
(3) (4) A
(4) A(5) NH4+ + H2O
 NH3.H2O + H+ ; C(NO3--) > C(NH4+) > C( H+) > C(O H--)
NH3.H2O + H+ ; C(NO3--) > C(NH4+) > C( H+) > C(O H--)试题分析:根据搞个的数据经方向可得:①是H;②是Na;③是O;④是Al;⑤是C;⑥是P;⑦是Cl;⑧是Na;⑨是N;⑩是F。(1)元素③、⑥和⑨的氢化物分别是H2O、PH3、 NH3;元素的非金属性O>N>P,这几种物质都是分子晶体。分子间通过分子间作用力结合。由于在H2O、NH3的分子之间除了存在分子间作用力外还存在氢键,增加了分子之间的相互作用,所以沸点最低的是PH3。由于O元素的非金属性比N强,所以H2O的氢键也强于NH3。因此三种物质中沸点由高到低的顺序是H2O> NH3>PH3。(2)元素H和N可形成阳离子NH4+ ,其结构式为
 ;(3)某元素R的原子半径为1.02×10 -10m,介于P与Cl原子半径之间,所以该元素是S。所以它与钠形成Na2S2的电子式是
;(3)某元素R的原子半径为1.02×10 -10m,介于P与Cl原子半径之间,所以该元素是S。所以它与钠形成Na2S2的电子式是 ;(4)元素Na和Cl形成NaCl晶体是离子晶体。阳离子与阴离子的配位数但是6个。其结构可用A表示。(5)H、O、N可以形成原子个数之比为4:3:2的中学常见无机化合物是NH4NO3,该物质是强酸弱碱盐,铵根离子水解消耗水电离产生的OH-,使溶液中的H+浓度增大,因此溶液显酸性。水解的离子方程式为NH4+ + H2O
;(4)元素Na和Cl形成NaCl晶体是离子晶体。阳离子与阴离子的配位数但是6个。其结构可用A表示。(5)H、O、N可以形成原子个数之比为4:3:2的中学常见无机化合物是NH4NO3,该物质是强酸弱碱盐,铵根离子水解消耗水电离产生的OH-,使溶液中的H+浓度增大,因此溶液显酸性。水解的离子方程式为NH4+ + H2O  NH3.H2O + H+ ; NH4NO3= NH4+ + NO3--。铵根离子水解消耗,所以C(NO3--) > C(NH4+);由于水解消耗了OH-,最终溶液中的H+浓度大于OH-的浓度。即C( H+) > C(O H--);盐的电离远大于弱电解质水的电离。因此C(NH4+) > C( H+)。综上所述,在溶液中离子浓度的关系是C(NO3--) > C(NH4+) > C( H+) > C(O H--)。
NH3.H2O + H+ ; NH4NO3= NH4+ + NO3--。铵根离子水解消耗,所以C(NO3--) > C(NH4+);由于水解消耗了OH-,最终溶液中的H+浓度大于OH-的浓度。即C( H+) > C(O H--);盐的电离远大于弱电解质水的电离。因此C(NH4+) > C( H+)。综上所述,在溶液中离子浓度的关系是C(NO3--) > C(NH4+) > C( H+) > C(O H--)。
练习册系列答案
相关题目


 →
→

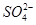 的空间构型为_________,H2O中O原子的杂化方式为____________。
的空间构型为_________,H2O中O原子的杂化方式为____________。 配离子。已知
配离子。已知 的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是____________________________。
的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是____________________________。 N形成的晶体结构如图所示,N3-的配位数是________。设晶胞边长为a cm,密度为b g/cm3,则阿伏加德罗常数可表示为___________(用含a、b的式子表示)。
N形成的晶体结构如图所示,N3-的配位数是________。设晶胞边长为a cm,密度为b g/cm3,则阿伏加德罗常数可表示为___________(用含a、b的式子表示)。