��Ŀ����
����Ŀ�����װ����ͼ��ʾ��������װ��KI��������Һ���м��������ӽ���Ĥ��������һ���ĵ�ѹ��ͨ�磬���������Һ����ɫ��һ��ʱ�����ɫ��dz����֪��3I2+6OH��=IO3��+5I��+3H2O������˵������ȷ���ǣ�������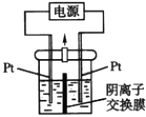
A.�Ҳ���ĵ缫����ʽ��2H2O+2e��=H2��+2OH��
B.������ʱ���Ҳ���Һ�к���IO3��
C.�����ڷ�����Ӧ���ܻ�ѧ����ʽKI+3H2O ![]() KIO3+3H2��
KIO3+3H2��
D.����������ӽ���Ĥ���������ӽ���Ĥ�������ڷ������ܻ�ѧ����ʽ����
���𰸡�D
����������һ���ĵ�ѹ��ͨ�磬���������Һ����ɫ��˵����ಬ˿���е����ɣ�����ಬ˿���������缫��ӦʽΪ 2I����2e��=I2��һ��ʱ�����ɫ��dz��˵��������Ӧ3I2+6OH��=IO3��+5I��+3H2O���Ҳಬ˿�������������������ӷŵ磬�缫��ӦʽΪ2H2O+2e��=H2��+2OH������֤������Һ�ʵ����ԣ�����IO3��ͨ�������ӽ���Ĥ���Ҳ��ƶ�������������ӽ���Ĥ���������ӽ���Ĥ��������K+ͨ�������ӽ���ĤǨ������������֤������Һ�ʵ����ԣ�
A��ͨ�����Ϸ���֪���Ҳ���ĵ缫����ʽ��2H2O+2e��=H2��+2OH������A���������⣻
B��һ��ʱ�����ɫ��dz��������Ӧ3I2+6OH��=IO3��+5I��+3H2O���м�Ϊ�����ӽ���Ĥ���Ҳ�I����OH��ͨ�������ӽ���Ĥ������ƶ�����֤������Һ�ʵ����ԣ�����IO3��ͨ�������ӽ���Ĥ���Ҳ��ƶ������Ҳ���Һ�к���IO3������B���������⣻
C��ͨ�����Ϸ���֪����ط�ӦʽΪKI+3H2O ![]() KIO3+3H2������C���������⣻
KIO3+3H2������C���������⣻
D������������ӽ���Ĥ���������ӽ���Ĥ�����缫Ϊ�������缫��ӦΪ��2I����2e��=I2���Ҳ�缫Ϊ�������缫��ӦʽΪ��2H2O+2e��=H2��+2OH������֤������Һ�ʵ����ԣ�������K+ͨ�������ӽ���ĤǨ�����������������I2���Ҳ���Һ����KOH���ɣ��ⵥ����KOH���ܷ�Ӧ���ܷ�Ӧ�൱�ڣ�2KI+2H2O ![]() 2KOH+I2+H2������D�������⣻
2KOH+I2+H2������D�������⣻
�ʴ�Ϊ��D��
��һ���ĵ�ѹ��ͨ�磬�����Һ����ɫ��˵����ಬ˿���е����ɣ�����ಬ˿��������һ��ʱ�����ɫ��dz��˵��������Ӧ3I2+6OH��=IO3��+5I��+3H2O���Ҳಬ˿����������֤������Һ�ʵ����ԣ�����IO3��ͨ�������ӽ���Ĥ���Ҳ��ƶ�������������ӽ���Ĥ���������ӽ���Ĥ��������K+ͨ�������ӽ���ĤǨ������������֤������Һ�ʵ����ԣ��ݴ˽��.

 ����5��2���ϵ�д�
����5��2���ϵ�д�����Ŀ���Թ�ҵ������ɰ���÷�����þ��Ϊԭ����ȡMgSO4H2O�Ĺ�����ͼ��ʾ�� 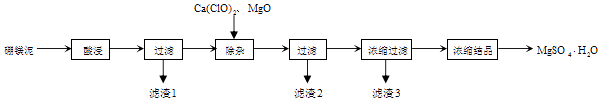
��þ�����Ҫ�ɷ������
MgO | SiO2 | FeO��Fe2O3 | CaO | Al2O3 | B2O3 |
30%��40% | 20%��25% | 5%��15% | 2%��3% | 1%��2% | 1%��2% |
���ϣ�B2O3����ˮ�γ����ᣬ��������������ˮ���ܽ�����¶ȵ����߶����ߣ�������þ��80���ܽ��������Գ��淽�����ѽ����߷��룬Ŀǰ�����ø��½ᾧ��
�ش��������⣺
��1��������1������Ҫ������д��ѧʽ��
��2��������2������Ҫ������д��ѧʽ�����жϡ����ӡ�������ɵļ��鷽����ȷ���� ��
A��ȡ�ϲ���Һ���μӱ�����Һ������ɫ
B��ȡ�ϲ���Һ���μ�KSCN�������
C��ȡ�ϲ���Һ���μ�K3[Fe��CN��6]��������ɫ����
��3������þ�������� �� ��ͬѧ��Ϊ��̼��þ��������þҪ�ã�ԭ���� ��
��4����������3Ӧ���ȹ��˵�ԭ���� �� ��������3���ĸҺ�к��е��������� �� ���Բ��ü�ѹ���ķ����õ�һˮ������þ��