题目内容
设NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A、标准状况下,0.1mol Cl2溶于水,转移的电子数目为0.1NA |
| B、常温常压下,64g S02含有的原子总数为3NA |
| C、标准状况下,11.2L SO3中含有分子的数目为0.5NA |
| D、常温常压下,1mol Na2O2中阴离子数为2NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.氯气溶于水,只有少量的氯气与水反应生成氯化氢和次氯酸;
B.64g二氧化硫的物质的量为1mol,1mol二氧化硫分子中含有3mol原子;
C.标准状况下,三氧化硫不是气体,不能使用标况下的气体摩尔体积计算三氧化硫的物质的量;
D.过氧化钠中阴离子为过氧根离子,1mol过氧化钠中含有1mol过氧根离子.
B.64g二氧化硫的物质的量为1mol,1mol二氧化硫分子中含有3mol原子;
C.标准状况下,三氧化硫不是气体,不能使用标况下的气体摩尔体积计算三氧化硫的物质的量;
D.过氧化钠中阴离子为过氧根离子,1mol过氧化钠中含有1mol过氧根离子.
解答:
解:A.0.1mol Cl2溶于水,只有少量氯气与水反应生成氯化氢和次氯酸,所以反应转移的电子小于0.1mol,转移的电子数目小于0.1NA,故A错误;
B.64g 二氧化硫的物质的量为1mol,1mol二氧化硫中含有1molS原子和2molO原子,总共含有3mol原子,含有的原子总数为3NA,故B正确;
C.标况下,三氧化硫不是气体,题中条件无法计算11.2L三氧化硫的物质的量,故C错误;
D.1mol过氧化钠中含有1mol过氧根离子,所以1mol Na2O2中阴离子数为NA,故D错误;
故选B.
B.64g 二氧化硫的物质的量为1mol,1mol二氧化硫中含有1molS原子和2molO原子,总共含有3mol原子,含有的原子总数为3NA,故B正确;
C.标况下,三氧化硫不是气体,题中条件无法计算11.2L三氧化硫的物质的量,故C错误;
D.1mol过氧化钠中含有1mol过氧根离子,所以1mol Na2O2中阴离子数为NA,故D错误;
故选B.
点评:本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意明确标准状况下三氧化硫不是气体,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,选项D为易错点,注意过氧化钠中的阴离子为过氧根离子.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
绿色电源“二甲醚-氧气燃料电池”的工作原理如图,所示下列说法正确的是( )
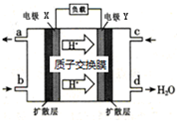

| A、氧气应从c处通入,电极Y上发生的反应为O2+4e-+2H2O═4OH- |
| B、电池在放电过程中,电极X周围溶液的pH增大 |
| C、二甲醚应从b处加入,电极X上发生的反应为(CH3)2O-12e-+3H2O=2CO2+12H+ |
| D、当该电池向外电路提供2mol电子时消耗O2约为22.4L |
已知25℃,醋酸、次氯酸、碳酸、亚硫酸的电离平衡常数如表,下列叙述正确的是( )
| 酸 | 电离平衡常数 |
| 醋酸 | Ki=1.75×10-5 |
| 次氯酸 | Ki=2.98×10-8 |
| 碳酸 | Ki1=4.30×10-7 Ki2=5.61×10-11 |
| 亚硫酸 | Ki1=1.54×10-2 Ki2=1.02×10-7 |
| A、25℃,等pH值的CH3COONa、NaClO、Na2CO3和Na2SO3四种溶液中,物质的量最小的是Na2CO3 |
| B、少量的SO2通入NaClO溶液中反应的离子方程式为:SO2+H2O+2ClO-→SO32-+2HClO |
| C、少量CO2通入Ca(ClO)2溶液中反应的离子方程式为:CO2+H2O+ClO-→HCO3-+HClO |
| D、向pH=a的醋酸溶液中加一定量水,所得溶液的pH>a、pH<a、pH=a均有可能 |
化合物M叫假蜜环菌甲素,它是香豆素类天然化合物.对M的性质叙述正确的是( )
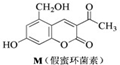

| A、M与Br2只能发生加成反应,不能发生取代反应 |
| B、M既能与FeCl3发生反应,也能与CH3COOH发生反应 |
| C、M可溶于NaOH稀溶液,1mol M最多消耗2mol NaOH |
| D、1mol M在催化剂作用下最多能与4mol H2发生加成反应 |
共价键、离子键和范德华力都是微观粒子之间的不同作用力,下列物质:①Na2O2;②SiO2;③碘;④金刚石;⑤NaCl;⑥白磷,其中含有两种作用力的组合是( )
| A、①②⑤ | B、①③⑥ |
| C、②④⑥ | D、①②③⑥ |
将一定量铁粉溶于1L稀硝酸中恰好完全反应,放出NO气体的体积为4.48L(标准状况下),则原溶液中硝酸的浓度为( )
| A、1.0mol?L-1 |
| B、0.8mol?L-1 |
| C、0.6mol?L-1 |
| D、0.4mol?L-1 |
第二周期元素,能与氧形成X2O5.则有关X的叙述正确的是( )
| A、X的单质在常温下以分子晶体形式存在 |
| B、X2O5的水化物是一种强酸 |
| C、X的氢化物在固态属于离子晶体 |
| D、X所在族元素的单质在固态时都属于同一晶体类型 |
 铊的相关信息卡片如图所示:
铊的相关信息卡片如图所示: