题目内容
生产甲醇的原料CO、H2可由下列反应制取:CH4(g)+H2O(g) CO(g)+3H2(g),试回答下列问题。
CO(g)+3H2(g),试回答下列问题。
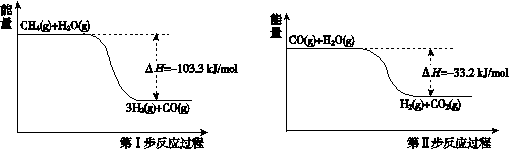
(1)已知:① CH4(g)+3/2 O2(g) CO(g)+2H2O(g)△Hl;
CO(g)+2H2O(g)△Hl;
② H2(g)+1/2 O2(g) H2O(g) △H2,
H2O(g) △H2,
则CH4(g)+ H2O(g) CO(g)+3H2(g)的△H=____ (用含△H1,△H2的式子表示)
CO(g)+3H2(g)的△H=____ (用含△H1,△H2的式子表示)
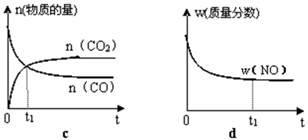
(2)一定条件下反应CH4(g)+H2O(g) CO(g)+3H2(g)中CH4的平衡转化率与温度、压强的关系如图,且T2>T1, 则上述反应的△H____ 0(填“<”、“>”、“=”,下同),A、B处对应平衡常数(KA、KB)的大小关系为KA____ KB
CO(g)+3H2(g)中CH4的平衡转化率与温度、压强的关系如图,且T2>T1, 则上述反应的△H____ 0(填“<”、“>”、“=”,下同),A、B处对应平衡常数(KA、KB)的大小关系为KA____ KB

(3)维持温度T2,将0.04 mol CH4和0.04mol H2O(g)通入容积为1L的定容密闭容器中发生反应,平衡时达到B点,测得CH4的转化率为50%,该反应在此温度下的平衡常数KB=____ ,下列现象能说明该反应已经达到平衡状态的是_ ___
a.容器内CH4、H2O、CO、H2的物质的量之比为1:1:1:3
b.容器的密度恒定
c.容器的压强恒定
d.3υ正(CO)=υ逆((H2)
(4)在上述B点平衡基础上,向容器中再通入amol CH4和a mol H2O气体,使之在C点重新达平衡,此时测得CO有0.03mol,则a=____ 。
 CO(g)+3H2(g),试回答下列问题。
CO(g)+3H2(g),试回答下列问题。(1)已知:① CH4(g)+3/2 O2(g)
 CO(g)+2H2O(g)△Hl;
CO(g)+2H2O(g)△Hl;② H2(g)+1/2 O2(g)
 H2O(g) △H2,
H2O(g) △H2,则CH4(g)+ H2O(g)
 CO(g)+3H2(g)的△H=____ (用含△H1,△H2的式子表示)
CO(g)+3H2(g)的△H=____ (用含△H1,△H2的式子表示)(2)一定条件下反应CH4(g)+H2O(g)
 CO(g)+3H2(g)中CH4的平衡转化率与温度、压强的关系如图,且T2>T1, 则上述反应的△H____ 0(填“<”、“>”、“=”,下同),A、B处对应平衡常数(KA、KB)的大小关系为KA____ KB
CO(g)+3H2(g)中CH4的平衡转化率与温度、压强的关系如图,且T2>T1, 则上述反应的△H____ 0(填“<”、“>”、“=”,下同),A、B处对应平衡常数(KA、KB)的大小关系为KA____ KB
(3)维持温度T2,将0.04 mol CH4和0.04mol H2O(g)通入容积为1L的定容密闭容器中发生反应,平衡时达到B点,测得CH4的转化率为50%,该反应在此温度下的平衡常数KB=____ ,下列现象能说明该反应已经达到平衡状态的是_ ___
a.容器内CH4、H2O、CO、H2的物质的量之比为1:1:1:3
b.容器的密度恒定
c.容器的压强恒定
d.3υ正(CO)=υ逆((H2)
(4)在上述B点平衡基础上,向容器中再通入amol CH4和a mol H2O气体,使之在C点重新达平衡,此时测得CO有0.03mol,则a=____ 。
(1)ΔH1—3ΔH2(2分) (2)> (2分); < (2分)
(3)1.08×10-2mol2?L-2(2分,单位可不作要求);acd(3分) (4)0.035(3分)
(3)1.08×10-2mol2?L-2(2分,单位可不作要求);acd(3分) (4)0.035(3分)
试题分析:(1)根据已知的热化学方程式以及盖斯定律可知,①-②×3即得到CH4(g)+ H2O(g)
 CO(g)+3H2(g),所以该反应的反应热△H=ΔH1—3ΔH2。
CO(g)+3H2(g),所以该反应的反应热△H=ΔH1—3ΔH2。(2)根据图像可知,在压强相同时,温度越高,甲烷的转化率越高。这说明升高温度平衡向正反应方向移动,因此正反应是吸热反应,即△H>0。升高温度平衡向正反应方向移动,因此B点对应的平衡常数大于A点对应的平衡常数。
(3) CH4(g)+H2O(g)
 CO(g)+3H2(g)
CO(g)+3H2(g)起始浓度(mol/L) 0.04 0.04 0 0
转化浓度(mol/L) 0.02 0.02 0.02 0.06
平衡浓度(mol/L) 0.02 0.02 0.02 0.06
所以该温度下该反应的平衡常数KB=
 =
= =1.08×10—2mol2?L-2
=1.08×10—2mol2?L-2在一定条件下,当可逆反应中正反应速率和逆反应速率相等时(但不为0),各种物质的浓度或含量均不再发生变化的状态,是化学平衡状态,根据以上分析可知,平衡时容器内CH4、H2O、CO、H2的物质的量之比为1:1:1:3,所以可以说明反应达到平衡状态,a正确;密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,因此密度始终是不变的,所以b不能说明;该反应是体积减小的可逆反应,所以当压强不再发生变化时,可以说明反应达到平衡状态,即c正确;d中的反应速率方向相反,且满足反应速率之比是相应的化学计量数之比,因此可以说明,d正确,答案选acd。
(4) CH4(g)+H2O(g)
 CO(g)+3H2(g)
CO(g)+3H2(g)起始浓度(mol/L) b b 0 0
转化浓度(mol/L) 0.03 0.03 0.03 0.09
平衡浓度(mol/L)b-0.03 b-0.03 0.03 0.09
因为温度不变,平衡常数不变,所以
 =1.08×10—2,解得b=0.075mol,因此a=0.075mol-0.04mol=0.035mol
=1.08×10—2,解得b=0.075mol,因此a=0.075mol-0.04mol=0.035mol
练习册系列答案
相关题目
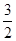 C(s)=
C(s)= 2CO2(g)+ N2(g)。△H<0
2CO2(g)+ N2(g)。△H<0
 N2O4(g) △H=-56.9 kJ/mol
N2O4(g) △H=-56.9 kJ/mol  N2(g)+CO2(g)。某研究小组向某密闭的真空容器(假设容器体积不变,固体试样体积忽略不计)中加入NO和足量的活性炭,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g)。某研究小组向某密闭的真空容器(假设容器体积不变,固体试样体积忽略不计)中加入NO和足量的活性炭,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下: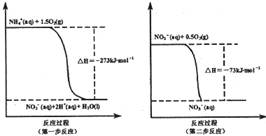
 2CO2+ N2 △H
2CO2+ N2 △H



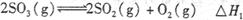

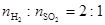 )。
)。