题目内容
研究硫及其化合物对于工农业生产具有重要意义。
(1)图Ⅰ所示一个容积为4L的密闭容器,内有可移动的隔板。一定温度(T)下,左室加入2 mol SO3,右室加入2 mol SO2和1 mol O2,在少量催化剂存在下分别发生反应:

左室:
右室:
反应达到平衡时,右室反应过程和能量关系如图Ⅱ所示。

①ΔH2=_______(含a的数学式表示);反应的平衡常数K=_________L·mol-1。
②能说明两边反应一定达到平衡的是______________(填序号)。
A.隔板不再移动
B.左右两边SO2的物质的量相等
C.左右二室中SO2与O2物质的量之比都是2∶1
③达平衡时,左室反应吸收的热量为Q1kJ,右室反应吸收的热量为Q2kJ,则Q1、Q2满足的关系是_____________(填序号)。
A.Q1=Q2
B.Q1>Q2
C.Q1<Q2
(2)高温下,炽热的Cu2S与水蒸气反应生成金属铜、H2和SO2( )。
)。
①写出该反应的化学反应方程式_____________________________________________。
②若有1 mol Cu2S参与反应,则转移电子的物质的量是_________mol。
(1)图Ⅰ所示一个容积为4L的密闭容器,内有可移动的隔板。一定温度(T)下,左室加入2 mol SO3,右室加入2 mol SO2和1 mol O2,在少量催化剂存在下分别发生反应:

左室:

右室:

反应达到平衡时,右室反应过程和能量关系如图Ⅱ所示。

①ΔH2=_______(含a的数学式表示);反应的平衡常数K=_________L·mol-1。
②能说明两边反应一定达到平衡的是______________(填序号)。
A.隔板不再移动
B.左右两边SO2的物质的量相等
C.左右二室中SO2与O2物质的量之比都是2∶1
③达平衡时,左室反应吸收的热量为Q1kJ,右室反应吸收的热量为Q2kJ,则Q1、Q2满足的关系是_____________(填序号)。
A.Q1=Q2
B.Q1>Q2
C.Q1<Q2
(2)高温下,炽热的Cu2S与水蒸气反应生成金属铜、H2和SO2(
 )。
)。①写出该反应的化学反应方程式_____________________________________________。
②若有1 mol Cu2S参与反应,则转移电子的物质的量是_________mol。
(1)①-1.25a kJ/mol 160
② AB ③ C
(2)①Cu2S+2H2O
 2Cu+ 2SO2 + H2 ②6
2Cu+ 2SO2 + H2 ②6试题分析:(1)①由图Ⅱ可以得出,反应物2molSO2平衡时为0.4mol,反应了1.6mol产生akJ的热量,故该反应的△H2=-2a/1.6=-1.25a kJ/mol相同条件下,左右室反应为等效平衡,达到平衡后两边体积相等为2L,
K=c2(SO3)/ c2(SO2) c(O2)=0.82/(0.22×0.1)=160
②A、该反应方程式两边化学计量数和不等,平衡移动会导致气体体积变化,隔板不动,即说明反应达到平衡,正确;B、两边是等效平衡,平衡后完全相同,若不相等则没有达到平衡,正确;C、加入的量是比是2∶1,反应的量为比也是2∶1,所以任何时间左右二室中SO2与O2物质的量之比都是2∶1,错误。
③平衡状态时SO3的物质的量为1.6mol,显然左室反应的量少,吸收的热量比右室反应的放出的热量少,所以Q1<Q2
(2)①该反应化学方程式为Cu2S+2H2O
 2Cu+ 2SO2 + H2 ②6
2Cu+ 2SO2 + H2 ②6
练习册系列答案
相关题目

 CO2(g)+H2(g) △H=-41.2kJ·mol-1
CO2(g)+H2(g) △H=-41.2kJ·mol-1 CH3CH2OH(g)+3H2O(l) △H= 。
CH3CH2OH(g)+3H2O(l) △H= 。

 CO(g)+3H2(g),试回答下列问题。
CO(g)+3H2(g),试回答下列问题。

 Na2CO3(s)+10H2O(g)
Na2CO3(s)+10H2O(g) ="+532.36" kJ·mol-1
="+532.36" kJ·mol-1
 CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
 (mol/L)-2
(mol/L)-2
 、
、 、CO等大气污染气体的测量及处理具有重要意义。
、CO等大气污染气体的测量及处理具有重要意义。 可使
可使 等氧化,常用于定量测定CO的含量。已知:
等氧化,常用于定量测定CO的含量。已知:
 反应生成
反应生成 的热化学方程式:________________。
的热化学方程式:________________。

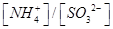 ________2(填“>”“<”或“=”)
________2(填“>”“<”或“=”) 可用强碱溶液吸产生硝酸盐。在酸性条件下,FeSO4溶液能将
可用强碱溶液吸产生硝酸盐。在酸性条件下,FeSO4溶液能将 还原为NO,写出该过程中产生NO反应的离子方程式___________________________________。
还原为NO,写出该过程中产生NO反应的离子方程式___________________________________。
 2CO2+N2能够自发进行,则该反应的ΔH 0(填“>”或“<”)。
2CO2+N2能够自发进行,则该反应的ΔH 0(填“>”或“<”)。

 2NH3(g),按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时有关数据如下:
2NH3(g),按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时有关数据如下: H2NCOONH4 (l) (氨基甲酸铵) △H1
H2NCOONH4 (l) (氨基甲酸铵) △H1
