题目内容
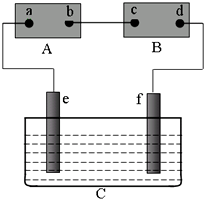
12.下列叙述正确的是( )| A. | 在原电池的负极和电解池的阴极上都是发生失电子的氧化反应 | |
| B. | 用惰性电极电解MgCl2溶液的反应原理:2Cl-+2H2O $\frac{\underline{\;电解\;}}{\;}$ Cl2↑+H2↑+2OH- | |
| C. | 用惰性电极电解稀H2SO4溶液一段时间后,溶液的酸性增强 | |
| D. | 镀层破损后,镀锡铁板比镀锌铁板更耐腐蚀 |
分析 A、原电池负极和电解池阳极上的物质都是失电子发生氧化反应,原电池正极和电解池阴极上的得电子发生还原反应;
B、用惰性电极电解氯化镁溶液时,阳极上氯离子放电,阴极上氢离子放电;
C、用惰性电极电解稀H2SO4溶液相当于电解水;
D、铁、锡和合适的电解质溶液构成的原电池中,铁作负极,易被腐蚀,锌、铁和合适的电解质溶液构成的原电池中,锌作负极,铁作正极被保护.
解答 解:A、电解池的阴极上发生还原反应,故A错误;
B、用惰性电极电解氯化镁溶液时,阳极上氯离子放电,阴极上氢离子放电,其离子方程式为:Mg2++2Cl -+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+Mg(OH)2↓,故B错误;
C、用惰性电极电解H2SO4溶液,本质上是电解水,溶液中的溶质不变,但溶剂的量改变,溶液的浓度增大,则溶液的酸性增强,故C正确;
D、镀层破损后,镀锡铁板中铁加快腐蚀,镀锌铁板中铁被保护,所以镀锌铁板比镀锡铁板更耐腐蚀,故D错误;
故选C.
点评 本题考查了原电池原理、电解池原理及金属的腐蚀与防护,易错选项是C,注意用惰性电极电解氢氧化钠或稀硫酸时,实则电解的是水,溶液中的溶质不变而溶剂改变,导致溶液的浓度改变,从而引起溶液的pH改变.

练习册系列答案
相关题目
17.扑热息痛是一种优良的解热镇痛药,其结构为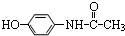 ,则有关它的性质错误的是( )
,则有关它的性质错误的是( )
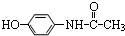 ,则有关它的性质错误的是( )
,则有关它的性质错误的是( )| A. | 与氢氧化钠溶液共热消耗2molNaOH | B. | 能与浓溴水发生取代反应 | ||
| C. | 不能使酸性高锰酸钾溶液褪色 | D. | 遇三氯化铁溶液呈现紫色 |
18.下列叙述正确的是( )
| A. | 24Mg32S 晶体中电子总数与中子总数之比为 1:1 | |
| B. | CO2和 PCl5分子中各原子最外层都满足 8 电子结构 | |
| C. | 若 aXm+ 和 bYn- 两种离子电子层结构相同,则 a-b=n-m | |
| D. | 元素周期表中第 4 列元素形成的化合物数目最多 |
15.下列反应能发生的是( )
| A. | 氯化钠溶液和稀硫酸 | B. | 氯化钠固体和浓磷酸共热 | ||
| C. | 硝酸钠固体和浓盐酸 | D. | 亚硫酸钠固体和中等浓度硫酸 |
4.下表中实验操作能达到实验目的或得出正确结论的是( )
| 选项 | 实验操作 | 实验目的或结论 |
| A | SO2通入溴水中,溶液褪色 | 检验SO2的漂白性 |
| B | 向2mL淀粉溶液中加入稀硫酸,加热2min,加入新制Cu(OH)2在加热,无明显现象. | 淀粉在酸性条件下不水解 |
| C | 将制得的阿司匹林粗产品与饱和碳酸氢钠溶液充分反应后过滤 | 除去阿司匹林中的聚合物 |
| D | 等体积、pH同为3的酸A和B分别与足量的Zn反应,酸A放出的氢气多 | 酸性A比B强 |
| A. | A | B. | B | C. | C | D. | D |
1.有关气体制备所用试剂及检验气体所用试剂不正确的组合是( )
| A. | CO2;大理石和稀硫酸,澄清石灰水 | |
| B. | Cl2;二氧化锰和浓盐酸,湿润的淀粉碘化钾试纸 | |
| C. | O2;二氧化锰和双氧水,带火星的木条 | |
| D. | NH3;氯化铵固体和氢氧化钙固体,湿润的红色石蕊试纸 |
2.下列反应中前者属于取代反应,后者属于加成反应的是( )
| A. | 甲烷与氯气混和后光照反应;乙烯使酸性高锰酸钾溶液的褪色 | |
| B. | 乙烯与溴的四氯化碳溶液反应;苯与氢气在一定条件下反应生成环己烷 | |
| C. | 在浓硫酸作用下,苯在55℃左右与浓硝酸的反应; 乙烯与水生成乙醇的反应 | |
| D. | 在苯中滴入溴水,溴水褪色; 乙烯自身生成聚乙烯的反应 |