题目内容
17.如图中A为直流电源,B为浸透饱和食盐水溶液和酚酞试液的滤纸,C为盛有CuSO4溶液的电解槽,e为铜电极,f为铁电极.接通电路后,发现e电极质量增加,则:(1)电源A上b为正极;
(2)电解过程中,d点出现的现象是出现红色,c点的电极反为2Cl--2e-═Cl2↑,B上的总反应为2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2NaOH;
(3)电解过程中,c的溶液中可观察到的现象是溶液由蓝色逐渐变为浅绿色,e电极上的电极反应式为Cu2++2e-═Cu,f电极上的电极反应式为Fe-2e-═Fe2+.
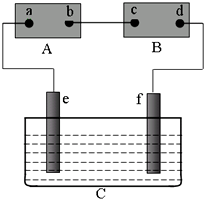
分析 (1)A为直流电源,B为浸透饱和氯化钠溶液和酚酞试液的滤纸,C为盛有CuSO4溶液的电解槽,e为铜电极,f为铁电极.接通电路后,发现e电极质量增加即生成铜,所以e是阴极、f是阳极,则a是负极、b是正极,c是阳极、d是阴极;
(2)滤纸B上,阴极d上氢离子放电生成氢气、同时电极附近有氢氧根离子生成,阳极c上氯离子放电生成氯气;
(3)c的溶液中e是阴极析出铜,f是阳极为铁失电子生成二价铁离子,据此分析.
解答 解:(1)A为直流电源,B为浸透饱和氯化钠溶液和酚酞试液的滤纸,C为盛有CuSO4溶液的电解槽,e为铜电极,f为铁电极.接通电路后,发现e电极质量增加即生成铜,所以e是阴极、f是阳极,则a是负极、b是正极,c是阳极、d是阴极,故答案为:正;
(2)滤纸B上,阴极d上氢离子放电生成氢气,同时电极附近有氢氧根离子生成,反应式为:2H++2e-=H2,看到的现象为出现红色,阳极c上氯离子放电生成氯气,反应式为:2Cl--2e-═Cl2↑,电池反应式为2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2NaOH,
故答案为:出现红色;2Cl--2e-═Cl2↑;2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2NaOH;
(3)c的溶液中e是阴极析出铜,反应式:Cu2++2e-═Cu;f是阳极铁失电子生成二价铁离子,反应式:Fe-2e-═Fe2+;c的溶液中可观察到的现象是溶液由蓝色逐渐变为浅绿色;故答案为:溶液由蓝色逐渐变为浅绿色;Cu2++2e-═Cu;Fe-2e-═Fe2+.
点评 本题考查电解原理,明确各个电极上发生的反应是解本题关键,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
3.下列说法错误的是( )
| A. | NH4NO3溶于水吸热,说明其溶于水不是自发过程 | |
| B. | 同一物质气态时熵值最大,液态时次之,而固态时熵值最小 | |
| C. | 物质发生氧化还原反应都伴有能量转化 | |
| D. | 由能量判据和熵判据组合成的复合判据,更适合于所有的过程 |
5.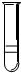 分别将5ml下列物质分别注入15ml水中,振荡后静置,能形成如图所示的是( )
分别将5ml下列物质分别注入15ml水中,振荡后静置,能形成如图所示的是( )
①溴苯②乙酸乙酯③乙醇④甘油⑤油酸甘油酯⑥硝基苯.
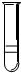 分别将5ml下列物质分别注入15ml水中,振荡后静置,能形成如图所示的是( )
分别将5ml下列物质分别注入15ml水中,振荡后静置,能形成如图所示的是( )①溴苯②乙酸乙酯③乙醇④甘油⑤油酸甘油酯⑥硝基苯.
| A. | 全部 | B. | ①②⑤⑥ | C. | ②⑤ | D. | ①⑥ |
12.下列叙述正确的是( )
| A. | 在原电池的负极和电解池的阴极上都是发生失电子的氧化反应 | |
| B. | 用惰性电极电解MgCl2溶液的反应原理:2Cl-+2H2O $\frac{\underline{\;电解\;}}{\;}$ Cl2↑+H2↑+2OH- | |
| C. | 用惰性电极电解稀H2SO4溶液一段时间后,溶液的酸性增强 | |
| D. | 镀层破损后,镀锡铁板比镀锌铁板更耐腐蚀 |
2.将经过酸洗除锈的铁钉,用饱和食盐水浸泡后放入如图所示的装置中,下列叙述正确是( )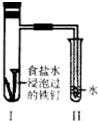

| A. | 过一段时间,Ⅱ试管中的导管内水柱上升 | |
| B. | Ⅰ试管中铁钉由于发生电解反应而被腐蚀 | |
| C. | 铁钉在该试管中的腐蚀速度越来越快 | |
| D. | Ⅰ试管中铁钉发生反应的一个电极方程式为:2Cl--2e-=Cl2↑ |
9.请回答下列问题:
(1)N、Al、Si、Zn四种元素中,有一种元素的电离能数据如下:
则该元素是Al(填写元素符号).
(2)锗(Ge)可能的性质或应用有CD_.
A.是一种活泼的金属元素 B.其电负性大于硫
C.其单质可作为半导体材料 D.其最高价氯化物的沸点低于其溴化物的沸点
(3)关于化合物HOH2CCH2OH,下列叙述正确的有ABD.
A.分子间可形成氢键 B.分子中既有极性键又有非极性键
C.分子中有7个σ键和1个π键 D.该分子在水中的溶解度大于2-丁烯
(4)NaF晶体的熔点>[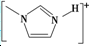 ]BF${\;}_{4}^{-}$的熔点(填>、=或<),其原因是两者均为离子化合物,且电荷数均为1,但后者离子半径大,离子键较弱,因此熔点较低.
]BF${\;}_{4}^{-}$的熔点(填>、=或<),其原因是两者均为离子化合物,且电荷数均为1,但后者离子半径大,离子键较弱,因此熔点较低.
(1)N、Al、Si、Zn四种元素中,有一种元素的电离能数据如下:
| 电离能 | I1 | I2 | I3 | I4 | … |
| Im/kJ•mol-1 | 578 | 1 817 | 2 745 | 11 578 | … |
(2)锗(Ge)可能的性质或应用有CD_.
A.是一种活泼的金属元素 B.其电负性大于硫
C.其单质可作为半导体材料 D.其最高价氯化物的沸点低于其溴化物的沸点
(3)关于化合物HOH2CCH2OH,下列叙述正确的有ABD.
A.分子间可形成氢键 B.分子中既有极性键又有非极性键
C.分子中有7个σ键和1个π键 D.该分子在水中的溶解度大于2-丁烯
(4)NaF晶体的熔点>[
 ]BF${\;}_{4}^{-}$的熔点(填>、=或<),其原因是两者均为离子化合物,且电荷数均为1,但后者离子半径大,离子键较弱,因此熔点较低.
]BF${\;}_{4}^{-}$的熔点(填>、=或<),其原因是两者均为离子化合物,且电荷数均为1,但后者离子半径大,离子键较弱,因此熔点较低.
7.同分异构体现象在有机化学中是非常普遍的,下列互为同分异构体的是( )
①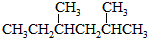 ②
②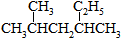 ③CH3CH2CH3
③CH3CH2CH3
④HC≡CCH3 ⑤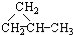 ⑥CH3CH=CHCH3.
⑥CH3CH=CHCH3.
①
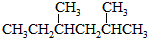 ②
②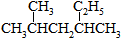 ③CH3CH2CH3
③CH3CH2CH3④HC≡CCH3 ⑤
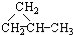 ⑥CH3CH=CHCH3.
⑥CH3CH=CHCH3.| A. | ①和② | B. | ①和③ | C. | ①和④ | D. | ⑤和⑥ |
 H、C、N、O是几种重要的非金属元素.回答以下问题:
H、C、N、O是几种重要的非金属元素.回答以下问题: .
.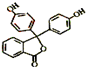 从其结构上看,酚酞属于酚或酯类衍生物,
从其结构上看,酚酞属于酚或酯类衍生物,