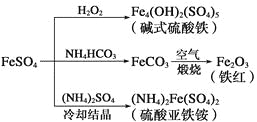
题目内容
【题目】1L某溶液中含有的离子如下表:
离子 |
|
|
|
|
物质的量浓度
| 1 | 1 |
| 1 |
用惰性电极电解该溶液,当电路中有![]() 通过时(忽略电解时溶液体积的变化及电极产物可能存在的溶解现象),下列说法正确的是
通过时(忽略电解时溶液体积的变化及电极产物可能存在的溶解现象),下列说法正确的是
A.电解后混合溶液的pH=0B.a=3
C.阳极生成![]() D.阴极析出的金属是铜与铝
D.阴极析出的金属是铜与铝
【答案】A
【解析】
由溶液电荷守恒可知2c(Cu2+)+3c(Al3+)=c(NO3-)+c(Cl-),可求得c(NO3-)=4moL/L,
由于离子放电顺序Cu2+>H+>Al3+,Cl->OH->NO3-,电解时阳极首先发生:2Cl--2e-=Cl2↑,然后发生4OH--4e-=O2↑+2H2O,阴极首先发生:Cu2++2e-=Cu,然后发生2H++2e-=H2↑,结合相关离子的物质的量进行解答。
氯离子的物质的量=1mol/L×1L=1mol,铜离子的物质的量=1mol/L×1L=1mol,依据电解过程中存在电子守恒,结合电极反应计算分析产物,用惰性电极电解该溶液,当电路中有3mole通过时
阳极电极反应为: 2Cl2e=Cl2↑;
1mol 1mol 0.5mol
4OH4e=2H2O+O2↑
2mol(3-1)mol 1mol
阴极电极反应为:Cu2++2e=Cu
1mol 2mol 1mol
2H++2e=H2↑
1mol (3-2)mol 0.5mol
A. 电解后溶液PH计算,依据两电极上的反应计算,阳极减少2mol氢氧根离子,同时阴极上减少1mol氢离子,综合计算分析得到溶液中增加氢离子物质的量为1mol,氢离子浓度为1mol/L,pH=0,故A正确;
B.依据溶液中电荷守恒计算忽略氢离子和氢氧根离子浓度:2c(Cu2+)+3c(Al3+)=c(Cl)+c(NO3),计算得到c(NO3)=4mol/L,即a=4,故B错误;
C. 依据电极反应电子守恒可知阳极生成0.5molCl2,故C错误;
D.由于在阴极的放电顺序为: H+>Al3+,故Al3+不可能放电,故D错误;
答案选A。

 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案【题目】甲醚(CH3OCH3)是一种新型能源。
已知①CO(g)+2H2(g)CH3OH(g) H1=-99kJ/mol
②2CH3OH(g)CH3OCH3(g)+H2O(g) H2=-24kJ/mol
③CO(g)+H2O(g)CO2(g)+H2(g) H3=-41kJ/mol
回答下列问题:
(1)写出CO和H2反应生成CO2和CH3OCH3(g)的热化学方程式:________________。
(2)下列措施能提高反应①中CO的平衡转化率的是________(填字母)。
A.增大压强 B.升高温度 C.增大H2浓度 D.加高效催化剂
(3)在恒温恒容条件下只发生反应③,下列情况表明该反应达到平衡的是________(填字母)。
A.气体压强保持不变 B.气体密度保持不变
C.![]() 保持不变 D.浓度商保持不变
保持不变 D.浓度商保持不变
(4)在一定温度(T℃)下,向恒容密闭容器中投入一定量CH3OH气体,只发生反应②。气体混合物中CH3OCH3的物质的量分数[φ(CH3OCH3)]与反应时间(t)的有关数据如表所示。
t/min | 0 | 15 | 30 | 45 | 80 | 100 |
[φ(CH3OCH3)] | 0 | 0.05 | 0.08 | 0.09 | 0.10 | 0.10 |
①30min时,CH3OH的转化率α(CH3OH)________%;该温度下,上述反应的平衡常数K=________(用分数表示)。
②反应速率v=v正-v逆,其中v正=k正φ2(CH3OH)、v逆=k逆φ(CH3OCH3)φ(H2O),k正、k逆分别为正、逆反应速率常数,只与温度有关,φ为物质的量分数。15min时![]() ________(结果保留2位小数)
________(结果保留2位小数)
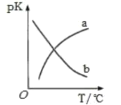
(5)在密闭容器中发生反应③,平衡常数为K,pK=-lg2K。pK温度的关系如图所示,图中曲线________(填“a”或“b”)能反映平衡常数变化趋势。
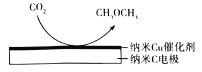
(6)在CO2处理过的饱和KHCO3溶液中,电解活化的CO2制备CH3OCH3的原理如图所示,阴极有HCO3-生成,该电的电极反应式为________。
【题目】根据有机化合物的命名原则,下列命名正确的是
A.![]() 3-甲基-1,3-丁二烯
3-甲基-1,3-丁二烯
B.![]() 2-羟基丁烷
2-羟基丁烷
C.CH3CH(C2H5)CH2CH2CH3 2-乙基戊烷
D.(CH3)3CCl 2-甲基-2-氯丙烷