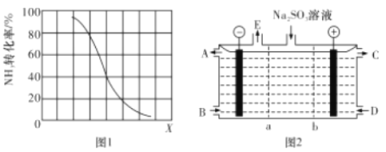
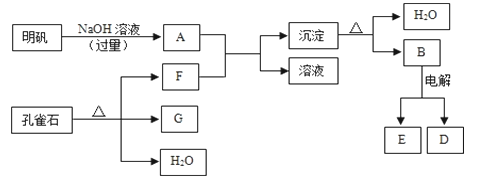
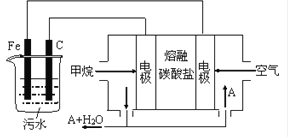
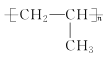题目内容
【题目】向100mLFeBr2溶液中通入标况下氯气6.72L,氯气全部被还原,测得溶液c(Br-)=c(Cl-),原溶液中FeBr2溶液的浓度( )(mol·L-1)
A.2B.4C.4.5D.6
【答案】B
【解析】
还原性Fe2+>Br-,所以通入氯气先发生反应![]() ,Fe2+反应完毕,剩余的氯气再反应反应
,Fe2+反应完毕,剩余的氯气再反应反应![]() ,溶液中含有Br-,说明氯气完全反应,Cl2的物质的量为
,溶液中含有Br-,说明氯气完全反应,Cl2的物质的量为![]() ,若Br-没有反应,则n(FeBr2)=0.5n(Br-)=0.3mol,0.3molFe2+只能消耗0.15mol的Cl2,故有部分Br-参加反应,设FeBr2的物质的量为x,则n(Fe2+)=xmol,n(Br-)=2xmol,未反应的n(Br-)=0.6mol,参加反应的n(Br-)=(2x-0.6)mol,根据电子转移守恒列方程计算x值,再根据c=nV计算。
,若Br-没有反应,则n(FeBr2)=0.5n(Br-)=0.3mol,0.3molFe2+只能消耗0.15mol的Cl2,故有部分Br-参加反应,设FeBr2的物质的量为x,则n(Fe2+)=xmol,n(Br-)=2xmol,未反应的n(Br-)=0.6mol,参加反应的n(Br-)=(2x-0.6)mol,根据电子转移守恒列方程计算x值,再根据c=nV计算。
还原性Fe2+>Br-,所以通入氯气先发生反应![]() ,Fe2+反应完毕,剩余的氯气再反应反应
,Fe2+反应完毕,剩余的氯气再反应反应![]() ,溶液中含有Br-,说明氯气完全反应,Cl2的物质的量为
,溶液中含有Br-,说明氯气完全反应,Cl2的物质的量为![]() ,若Br-没有反应,则n(FeBr2)=0.5n(Br-)=0.3mol,0.3molFe2+只能消耗0.15mol的Cl2,故有部分Br-参加反应,设FeBr2的物质的量为x,则n(Fe2+)=xmol,n(Br-)=2xmol,未反应的n(Br-)=0.6mol,参加反应的n(Br-)=(2x-0.6)mol 根据电子转移守恒有
,若Br-没有反应,则n(FeBr2)=0.5n(Br-)=0.3mol,0.3molFe2+只能消耗0.15mol的Cl2,故有部分Br-参加反应,设FeBr2的物质的量为x,则n(Fe2+)=xmol,n(Br-)=2xmol,未反应的n(Br-)=0.6mol,参加反应的n(Br-)=(2x-0.6)mol 根据电子转移守恒有![]() ,解得x=0.4mol,所以原FeBr2溶液的物质的量浓度为
,解得x=0.4mol,所以原FeBr2溶液的物质的量浓度为![]() ,故答案选B。
,故答案选B。

练习册系列答案
 优学名师名题系列答案
优学名师名题系列答案
相关题目