题目内容
碳、硅元素的单质和化合物的发现及应用,对于推动人类文明具有重要意义.高纯硅是重要的信息材料.
(1)硅元素的原子结构示意图为 .
(2)工业生产粗硅的反应有:
SiO2+2C
Si(粗)+2CO↑
SiO2+3C
SiC+2CO↑
若参加反应的C和SiO2的物质的量之比为5:2,则所得产品中单质硅与碳化硅的质量之比为 .
(3)工业上可以通过如图所示的流程制取纯硅:

①若反应A为Si(粗)+3HCl
SiHCl3+H2,则反应B的化学方程式为 .
②整个制备过程必须严格控制无水无氧.SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,则该反应的化学方程式为 ;H2还原SiHCl3过程中若混入O2,可能引起的后果是 (写出1条即可).
③假设每一轮次制备1mol纯硅,且生产过程中硅元素没有损失,反应A中HCl的利用率为90%,反应B中H2的利用率为93.75%,则在第二轮次的生产中,补充投入HCl和H2的物质的量之比约是 .
(1)硅元素的原子结构示意图为
(2)工业生产粗硅的反应有:
SiO2+2C
| ||
SiO2+3C
| ||
若参加反应的C和SiO2的物质的量之比为5:2,则所得产品中单质硅与碳化硅的质量之比为
(3)工业上可以通过如图所示的流程制取纯硅:

①若反应A为Si(粗)+3HCl
| ||
②整个制备过程必须严格控制无水无氧.SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,则该反应的化学方程式为
③假设每一轮次制备1mol纯硅,且生产过程中硅元素没有损失,反应A中HCl的利用率为90%,反应B中H2的利用率为93.75%,则在第二轮次的生产中,补充投入HCl和H2的物质的量之比约是
考点:硅和二氧化硅
专题:碳族元素
分析:(1)原子结构示意图中圆内数字为原子的质子数;圆外的弧线为电子层、弧线上的数字为该层上的电子数,据此进行解答;
(2)根据方程式中碳和二氧化硅、硅、碳化硅之间的关系式计算;
(3)①根据反应物、生成物和反应条件写出反应方程式;
②SiHCl3遇水剧烈反应生成H2SiO3、HCl和氢气;氧气与氢气混合,可能引起的后果是可能发生爆炸;
③反应生产1mol纯硅需补充HCl:
-3,需补充H2:
-1;
(2)根据方程式中碳和二氧化硅、硅、碳化硅之间的关系式计算;
(3)①根据反应物、生成物和反应条件写出反应方程式;
②SiHCl3遇水剧烈反应生成H2SiO3、HCl和氢气;氧气与氢气混合,可能引起的后果是可能发生爆炸;
③反应生产1mol纯硅需补充HCl:
| 3 |
| 90% |
| 1 |
| 93.95% |
解答:
解:(1)硅的原子序数为14,原子核外有3个电子层,最外层电子数为4,则原子结构示意图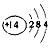 ,
,
故答案为: ;
;
(2)根据反应方程式生成1mol Si需C 2mol、SiO2 1mol,生成1mol SiC需C 3mol,SiO2 1mol,设参加两个反应的SiO2的物质的量分别为X、2-X,
则SiO2 +2C
Si(粗)+2CO↑ SiO2 +3C
SiC+2CO↑
Xmol 2Xmol 2-Xmol 3(2-X)mol
根据碳守恒:2Xmol+3(2-X)mol=5mol,X=1mol,
则产品中Si与SiC的物质的量之比为1:1,则所得产品中单质硅与碳化硅的质量之比为28:40=7:10,
故答案为:7:10;
(3)①由工艺流程可知,反应Ⅱ是氢气与SiHCl3反应生成Si(纯)、HCl,反应方程式为:SiHCl3+H2
Si(纯)+3HCl,
故答案为:SiHCl3+H2
Si(纯)+3HCl;
②SiHCl3遇水剧烈反应生成H2SiO3、HCl和氢气:3SiHCl3+3H2O═H2SiO3+H2↑+3HCl,H2还原SiHCl3过程中若混入O2,氧气与氢气混合,可能引起的后果是可能发生爆炸(或SiHCl3被O2氧化),
故答案为:3SiHCl3+3H2O═H2SiO3+H2↑+3HCl;可能发生爆炸(或SiHCl3被O2氧化);
③反应生产1mol纯硅需补充HCl:
-3,需补充H2:
-1,补充HCl与H2的物质的量之比为≈5:1.
故答案为:5:1;
 ,
,故答案为:
 ;
;(2)根据反应方程式生成1mol Si需C 2mol、SiO2 1mol,生成1mol SiC需C 3mol,SiO2 1mol,设参加两个反应的SiO2的物质的量分别为X、2-X,
则SiO2 +2C
| ||
| ||
Xmol 2Xmol 2-Xmol 3(2-X)mol
根据碳守恒:2Xmol+3(2-X)mol=5mol,X=1mol,
则产品中Si与SiC的物质的量之比为1:1,则所得产品中单质硅与碳化硅的质量之比为28:40=7:10,
故答案为:7:10;
(3)①由工艺流程可知,反应Ⅱ是氢气与SiHCl3反应生成Si(纯)、HCl,反应方程式为:SiHCl3+H2
| ||
故答案为:SiHCl3+H2
| ||
②SiHCl3遇水剧烈反应生成H2SiO3、HCl和氢气:3SiHCl3+3H2O═H2SiO3+H2↑+3HCl,H2还原SiHCl3过程中若混入O2,氧气与氢气混合,可能引起的后果是可能发生爆炸(或SiHCl3被O2氧化),
故答案为:3SiHCl3+3H2O═H2SiO3+H2↑+3HCl;可能发生爆炸(或SiHCl3被O2氧化);
③反应生产1mol纯硅需补充HCl:
| 3 |
| 90% |
| 1 |
| 93.95% |
故答案为:5:1;
点评:本题考查了硅的制取过程,题目难度中等,依据题干提供的信息结合硅及其化合物的性质是解答的关键,计算是该题的难点,注意双水解时,可生成沉淀和气体.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列说法正确的是( )
| A、水加热到很高的温度都难以分解是因为水分子间存在氢键 |
| B、碳酸钠固体中不存在阴阳离子 |
| C、氢化锂三兄弟--LiH、LiD、LiT三种物质的质子数之比为4:5:6 |
D、乙醛分子的结构式为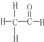 ,其一个分子中存在7对共用电子对 ,其一个分子中存在7对共用电子对 |
下列化合物内只有共价键的是( )
| A、CaCl2 |
| B、NaOH |
| C、H2SO4 |
| D、(NH4)2SO4 |
A、B、C、D、E、F为原子序数依次增大的短周期元素,其中A与E同主族,B和F同主族,E与F同周期.已知常温下A与E组成的单质状态不同,D的核电荷数是B的最外层电子数2倍,由F组成的单质是一种重要的半导体材料.下列说法不正确的是( )
| A、C的氢化物与C的最高价氧化物的水化物能发生化合反应 |
| B、元素的非金属性由强到弱的顺序是:D>C>B>F |
| C、原子半径由大到小的顺序是:E>F>C>D |
| D、F与D形成的化合物性质很不活泼,不与任何酸反应 |
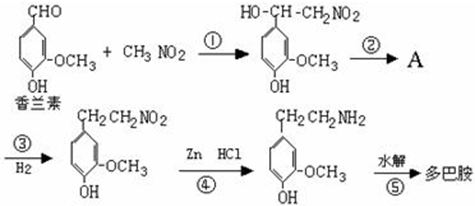
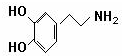 快乐是什么?专家通过实验发现:在大脑的相应部位--“奖赏中心”,给予柔和的电击,便会处于似乎极度快乐的状态.人们已经将“奖赏中心”各部分的脑电图绘制出来,并认为,在各区域之间传递信息的化学物质是多巴胺,所以“奖赏中心”又称为多巴胺系统.多巴胺结构如图:
快乐是什么?专家通过实验发现:在大脑的相应部位--“奖赏中心”,给予柔和的电击,便会处于似乎极度快乐的状态.人们已经将“奖赏中心”各部分的脑电图绘制出来,并认为,在各区域之间传递信息的化学物质是多巴胺,所以“奖赏中心”又称为多巴胺系统.多巴胺结构如图: