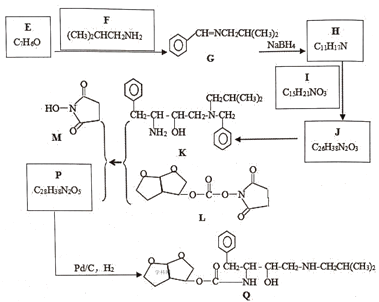
题目内容
【题目】CO和H2在一定条件下可以合成乙醇(CH3CH2OH):2CO(g)+4H2(g) ![]() CH3CH2OH(g)+H2O(g),下列叙述中能说明上述反应在一定条件下已达到最大限度的是( )
CH3CH2OH(g)+H2O(g),下列叙述中能说明上述反应在一定条件下已达到最大限度的是( )
A. CO全部转化为乙醇
B. 正反应和逆反应的化学反应速率均为零
C. 反应体系中乙醇的物质的量浓度不再变化
D. CO和H2以1:2的物质的量之比反应生成乙醇
【答案】C
【解析】该反应为可逆反应,CO不能全部转化为乙醇,A项错误;化学平衡是动态平衡,平衡时正逆反应速率相等,但不为0,B项错误;平衡时各物质的浓度不再变化, C项正确;化学反应中,反应物转化的物质的量之比等于化学计量数之比,不能作为判断是否达到化学平衡的依据,D项错误。

练习册系列答案
 智慧小复习系列答案
智慧小复习系列答案
相关题目