题目内容
【题目】已知:25℃时,Ksp[Zn(OH)2]=1.0×10-18,Ka(HCOOH)=1.0×10-4。该温度下,下列说法错误的是
A. Zn(OH)2溶于水形成的饱和溶液中c(Zn2+)>1.0×10-6 mol·L-l
B. HCOO-的水解常数为1.0×10-10
C. 向Zn(OH)2悬浊液中加入HCOOH,溶液中c(Zn2+)增大
D. Zn(OH)2+2HCOOH![]() =Zn2++2HCOO-+2H2O的平衡常数K=100
=Zn2++2HCOO-+2H2O的平衡常数K=100
【答案】A
【解析】A、Zn(OH)2溶于水形成的饱和溶液中,令饱和溶液中锌离子浓度为x,x×(2x)2=1.0×10-18,x=![]() =6.3×10-7 mol·L-l, c(Zn2+)<1.0×10-6 mol·L-l,故A错误;B、HCOO-的水解常数为
=6.3×10-7 mol·L-l, c(Zn2+)<1.0×10-6 mol·L-l,故A错误;B、HCOO-的水解常数为![]() 1.0×10-10,故B正确;C、向Zn(OH)2悬浊液中加入HCOOH,溶液中氢氧根离子减小,溶解平衡正向移动,溶液中c(Zn2+)增大,故C正确;D、Zn(OH)2+2HCOOH
1.0×10-10,故B正确;C、向Zn(OH)2悬浊液中加入HCOOH,溶液中氢氧根离子减小,溶解平衡正向移动,溶液中c(Zn2+)增大,故C正确;D、Zn(OH)2+2HCOOH![]() Zn2++2HCOO-+2H2O的平衡常数K=
Zn2++2HCOO-+2H2O的平衡常数K=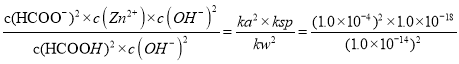 = 100,故D正确;故选A。
= 100,故D正确;故选A。

练习册系列答案
相关题目