题目内容
【题目】常温下用惰性电极电解200mLNaCl、CuSO4的混合溶液,所得气体的体积随时间变化如下图所示,根据图中信息回答下列问题:( 注:气体体积已换算成标准状况下的体积,且忽略气体在水中的溶解和溶液体积的变化.)
(1)曲线(选填“Ⅰ”或“Ⅱ”) 表示阳极产生气体的变化情况.
(2)NaCl的物质的量浓度为;CuSO4 的物质的量浓度 .
(3)t2时所得溶液的pH为 .
【答案】
(1)Ⅱ
(2)0.1mol/L;0.1mol/L
(3)1
【解析】解:刚开始时阴极Cu2+得电子,无气体放出,Cu2+反应完溶液中的H+放电,Ⅰ是H2 , 阳极先是溶液中的Cl﹣放电,反应完后溶液中的OH﹣放电,电解200mL一定浓度的NaCl与CuSO4混合溶液,阳极发生2Cl﹣﹣2e﹣=Cl2↑、4OH﹣﹣4e﹣=O2↑+2H2O,阴极发生Cu2++2e﹣=Cu、2H++2e﹣=H2↑,(1)通过以上分析知,I表示阴极生成的气体、II表示阳极生成的气体,所以答案是:Ⅱ;(2)由图可知,产生氯气为224mL,则由2Cl﹣﹣2e﹣=Cl2↑可知,n(NaCl)= ![]() ×2=0.02mol,所以c(NaCl)=
×2=0.02mol,所以c(NaCl)= ![]() =0.1mol/L,Ⅱ曲线中由t2时生成氧气为112mL,n(O2)=
=0.1mol/L,Ⅱ曲线中由t2时生成氧气为112mL,n(O2)= ![]() =0.005mol,则共转移电子为0.02mol+0.005mol×4=0.04mol,根据电子守恒及Cu2++2e﹣=Cu可知,n(CuSO4)=
=0.005mol,则共转移电子为0.02mol+0.005mol×4=0.04mol,根据电子守恒及Cu2++2e﹣=Cu可知,n(CuSO4)= ![]() =0.02mol,所以c(CuSO4)=
=0.02mol,所以c(CuSO4)= ![]() =0.1mol/L,所以答案是:0.1mol/L;0.1mol/L;(3)由t2时4OH﹣﹣4e﹣=O2↑+2H2O~4H+ , n(H+)=0.005mol×4=0.02mol,则溶液的c(H+)=
=0.1mol/L,所以答案是:0.1mol/L;0.1mol/L;(3)由t2时4OH﹣﹣4e﹣=O2↑+2H2O~4H+ , n(H+)=0.005mol×4=0.02mol,则溶液的c(H+)= ![]() =0.1mol/L,则溶液的pH=1,所以答案是:1.
=0.1mol/L,则溶液的pH=1,所以答案是:1.

 阅读快车系列答案
阅读快车系列答案【题目】某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定.
(1)将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)2NH3(g)+CO2(g).实验测得不同温度下的平衡数据列于下表:
温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
平衡总压强(kPa) | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
平衡气体总浓度(×10﹣3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
①可以判断该分解反应已经达到化学平衡的是(填字母).
A.2v(NH3)=v(CO2) B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变 D.密闭容器中氨气的体积分数不变
②根据表中数据,计算25.0℃时的分解平衡常数为 .
(2)已知:NH2COONH4+2H2ONH4HCO3+NH3H2O.该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO﹣)随时间变化趋势如图所示.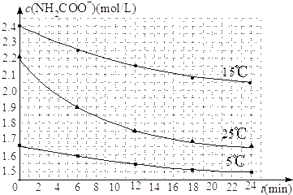
③计算25℃时,0~6min氨基甲酸铵水解反应的平均速率为 .
④根据图中信息,如何说明水解反应的平均速率随温度升高而增大: .