题目内容
【题目】某校化学兴趣小组的同学为了探究原电池工作的原理,进行了如下系列实验,请你一起参与实验并分析实验结果后回答有关问题: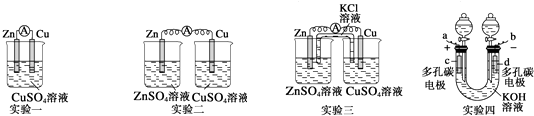
(1)实验一中铜片、锌片表面均有红色物质析出,电流计指针偏转,但较短时间内电流即明显减小.实验结束时测得锌片减少了3.94g,铜片增重了3.84g,则该原电池的工作效率是(指参加原电池反应的锌占反应总量的百分数).
(2)实验二中刚将铜、锌片插入溶液中时电流计指针有偏转,但立即就归零了.解释锌失去的电子能不能持续通过导线流向铜极给Cu2+ .
(3)实验三中盐桥中的K+流向溶液(填ZnSO4或CuSO4),如果Zn的消耗速率为1×10﹣3 mol/s,则K+的迁移速率为mol/s.
(4)实验四中,调节低压电源的电压到6V,并把其正、负极分别与上图装置中的两个碳电极相连接;接通电源,图示中的“+”连接到电源的正极上,“﹣”连接到电源的负极上,电解氢氧化钾溶液制取氢气、氧气,且制得的氢气与氧气的体积比为2:1,去掉电源,该装置就成为一只氢氧燃料电池,用带有一小灯泡的导线连接a、b,灯泡即可发亮.则下列说法错误的是 .
A.在电解KOH溶液制备H2和O2时,KOH的作用是增强溶液的导电性,一段时间后其浓度增大
B.当作为氢氧燃料电池时,c极发生氧化反应,d极发生还原反应
C.当作为氢氧燃料电池时,电解质溶液中的OH﹣向着d极移动
D.如将KOH溶液换成稀H2SO4 , 且作为氢氧燃料电池时,c极的电极反应为:O2+2H2O+4e﹣═4OH﹣ .
【答案】
(1)60%
(2)锌失电子则形成Zn2+进入溶液显正电性,Cu2+得电子则溶液显负电性,两种因素均阻碍电子流向铜板
(3)CuSO4;2×10﹣3
(4)BD
【解析】解:(1)铜片、锌片表面均有红色物质铜析出,理解减小的质量为:3.94g﹣3.84g=0.1g,根据反应关系式:Zn~Cu△m(减小)
65 64 1
6.5g 0.1g
参加反应的锌的质量为6.5g,根据电子守恒,参加原电池反应的锌的物质的量为n(Zn)=n(Cu)= ![]() =0.06mol,该原电池的工作效率为:
=0.06mol,该原电池的工作效率为: ![]() ×100%=60%,所以答案是:60%;(2)由于锌失电子则形成Zn2+进入溶液显正电性,Cu2+得电子则溶液显负电性,这两种因素均阻碍电子流向铜板,所以答案是:锌失电子则形成Zn2+进入溶液显正电性,Cu2+得电子则溶液显负电性,两种因素均阻碍电子流向铜板;(3)实验三中,铜为正极,锌为负极,电流在外电路有铜流向锌,溶液中电流由锌流向铜,所以钾离子流向硫酸铜溶液,氯离子流向硫酸锌溶液;根据电荷守恒可知,如果Zn的消耗速率为1×10﹣3mol/s,则钾离子则K+的迁移速率为2×10﹣3 , 所以答案是:CuSO4;2×10﹣3;(4)电解KOH溶液和电解硫酸溶液时,实际都是电解水,KOH溶液和硫酸溶液的浓度增大,阳极a上氢氧根离子发生氧化反应生成氧气,阴极b上氢离子发生还原反应生成氢气,形成氢氧燃料电池时,a电极上氧气发生还原反应,做正极,b电极上氢气放出氧化反应,做负极, A、电解KOH溶液,实际是电解水,KOH溶液的浓度增大,pH增大,故A正确; B、形成氢氧燃料电池时,c电极上氧气发生还原反应,做正极,d电极上氢气放出氧化反应,做负极,故B错误; C、在燃料电池中,阴离子移向负极d,故C正确; D、在酸性溶液中,氧气放电变化生成水,故D错误;故选BD.
×100%=60%,所以答案是:60%;(2)由于锌失电子则形成Zn2+进入溶液显正电性,Cu2+得电子则溶液显负电性,这两种因素均阻碍电子流向铜板,所以答案是:锌失电子则形成Zn2+进入溶液显正电性,Cu2+得电子则溶液显负电性,两种因素均阻碍电子流向铜板;(3)实验三中,铜为正极,锌为负极,电流在外电路有铜流向锌,溶液中电流由锌流向铜,所以钾离子流向硫酸铜溶液,氯离子流向硫酸锌溶液;根据电荷守恒可知,如果Zn的消耗速率为1×10﹣3mol/s,则钾离子则K+的迁移速率为2×10﹣3 , 所以答案是:CuSO4;2×10﹣3;(4)电解KOH溶液和电解硫酸溶液时,实际都是电解水,KOH溶液和硫酸溶液的浓度增大,阳极a上氢氧根离子发生氧化反应生成氧气,阴极b上氢离子发生还原反应生成氢气,形成氢氧燃料电池时,a电极上氧气发生还原反应,做正极,b电极上氢气放出氧化反应,做负极, A、电解KOH溶液,实际是电解水,KOH溶液的浓度增大,pH增大,故A正确; B、形成氢氧燃料电池时,c电极上氧气发生还原反应,做正极,d电极上氢气放出氧化反应,做负极,故B错误; C、在燃料电池中,阴离子移向负极d,故C正确; D、在酸性溶液中,氧气放电变化生成水,故D错误;故选BD.

