题目内容
迄今为止,由化学能转变的热能或电能仍然是人类使用的主要的能源。
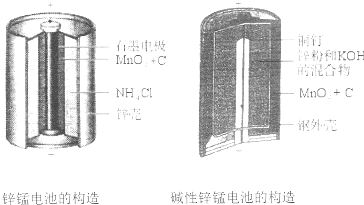
I.请仔细观察下列两种电池的构造示意图,完成下列问题:
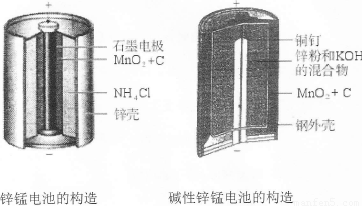
(1)碱性锌锰电池比普通锌锰电池(干电池)性能好,放电电流大。试从影响反应速率的因素分析其原因是 。
(2)碱性锌锰电池的总反应式:Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2,则负极的电极反应式为 。
Ⅱ.下面是一个将化学能与电能相互转化的装置。回答下列问题:
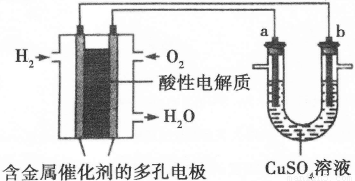
(1)写出通入O2一极的电极反应方程式为 。
(2)a电极是 极,能否写出其电极反应方程式 (填“能”或“不能”),若“能”写出其电极反应方程式,若“不能”说明其理由 。
(3)下列说法不正确的是( )
A.此装置用于电镀铜时,电解一段时间,硫酸铜溶液的浓度不变
B.U型管中,OH—在a极放电
C.若a为纯净金属,b为粗制金属,该装置可用于粗制金属的精炼
D.电子经导线流入b电极
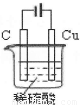
Ⅲ.某同学运用所学知识,自选材料设计实验,实现了在通常条件下不能发生的反应:Cu+H2SO4(稀)=CuSO4+H2↑。请在下面框中画出能够实验这一反应的装置图,并在图中进行必要的标注。

I.(1)碱性锌锰电池用锌粉替代了原锌锰电池的锌壳,增大了反应物的接触面积,加快了反应速率,故放电电流大(2分)
(2)Zn+2OHˉ—2eˉ=Zn(OH)2(2分)
Ⅱ.(1)O2+4e—+4H+=2H2O(2分)
(2)阳(1分) 不能(1分),因为a电极的电极材料不确定,所以不能写出其电极反应方程式(2分)
(3)BC(2分)
Ⅲ.(2分。图正确1分,标注1分)
【解析】
试题分析:I.(1)碱性锌锰电池用锌粉替代了原锌锰电池的锌壳,增大了反应物的接触面积,加快了反应速率,故放电电流大;(2)由电池工作环境、电子、电荷、原子守恒可知,正极反应式为2MnO2+2H2O+2eˉ=2MnOOH+2OHˉ,负极反应式为Zn+2OHˉ—2eˉ=Zn(OH)2;II.(1)由酸性条件、电子、电荷、原子守恒可知,正极反应式为O2+4e—+4H+=2H2O,负极反应式为2H2+4e—=4H+;(2)与燃料电池的正极相连,则a是电解池的阳极;由于不能确定阳极材料是否是惰性电极,因此不能写出阳极反应式;(3)A、电镀铜时,阳极反应式为Cu—2e—=Cu2+,阴极反应式为Cu2++2—=Cu,电镀液中Cu2+不变,正确;B、a是惰性电极时,OH—在a极上放电,若a是Cu等活性电极时,OH—不能在a极上放电,错误;C、粗制金属的电解精炼时,纯金属作阴极,粗制金属作阳极,错误;D、外电路中,电子从负极流出,经过导线流入阴极,正确;III.画图要点:铜与稀硫酸不能自发地反应,因此只能设计为电解池;铜元素由0价升高为+2价,发生氧化反应,则Cu一定是阳极,与直流电源的正极相连;可用石墨等导体作阴极,稀硫酸作电解液,H+移向阴极,并在阴极上发生还原反应,生成氢气。
考点:考查化学电源、电解及其应用、电极反应式的书写等相关知识。

(1)2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)△H=-2599kJ?mol-1,则乙炔的燃烧热为
(2)有些反应进行得很慢,有些反应不容易直接发生,有些反应的产品不纯(有副反应发生),这给测定反应热造成了困难,此时可利用盖斯定律,就可以间接地把它们的反应热计算出来.已知
①CO(g)+
| 1 |
| 2 |
②C(s)+O2(g)═CO2(g)△H2=-393.5kJ?mol-1
则C(s)+
| 1 |
| 2 |
(3)从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程.已知键能数据如表.
| 化学键 | 键能(kJ/mol) | 化学键 | 键能(kJ/mol) |
| N≡N | 942 | H-O | 460 |
| N-H | 391 | O=O | 499 |
| H-H | 437 |
 由化学能转变的热能或电能仍然是人类使用的主要能源.根据如图所示的装置,判断下列说法不正确的是( )
由化学能转变的热能或电能仍然是人类使用的主要能源.根据如图所示的装置,判断下列说法不正确的是( )