题目内容
【题目】下列实验中的颜色变化,与氧化还原反应无关的是( )
A. NaOH溶液滴入FeSO4溶液中,产生白色沉淀,随后变为红褐色
B. 石蕊溶液滴入氯水中,溶液变红,随后迅速褪色
C. Na2S溶液滴入AgCl浊液中,沉淀由白色逐渐变为黑色
D. 热铜丝插入稀硝酸中,产生无色气体,随后变为红棕色
【答案】C
【解析】
A、发生的离子反应是Fe2++2OH-=Fe(OH)2↓,然后再发生4Fe(OH)2+O2+2H2O=4Fe(OH)3,该反应为氧化还原反应,故A不符合题意;
B、氯水中存在Cl2+H2O![]() HCl+HClO,石蕊遇酸变红,HClO具有强氧化性,能将有色物质漂白,HClO漂白有色物质属于氧化还原反应,故B不符合题意;
HCl+HClO,石蕊遇酸变红,HClO具有强氧化性,能将有色物质漂白,HClO漂白有色物质属于氧化还原反应,故B不符合题意;
C、白色沉淀转变为黑色沉淀,发生2AgCl+Na2S=Ag2S+2NaCl,该反应没有化合价的变化,不属于氧化还原反应,故C符合题意;
D、铜丝与稀硝酸发生3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,该反应为氧化还原反应,故D不符合题意;
答案为C。

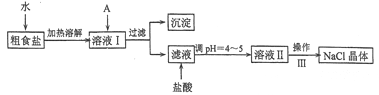
【题目】按要求回答下列问题:
(1)常温下向一定体积的0.1 mol/L醋酸溶液中加水稀释后,下列说法正确的是__________。
A 溶液中导电粒子的数目减少 B 醋酸的电离程度增大,c(H+)亦增大
C 溶液中c(CH3COO-)/[c(CH3COOH)c(OH-)]不变 D 溶液中c(CH3COO-)/c(H+)减小
(2)①常温下将0.15 mol/L稀硫酸V1 mL与0.1 mol/L NaOH溶液V2 mL混合,所得溶液的pH为1,则V1:V2=_____________(溶液体积变化忽略不计)。
(3)常温下,浓度均为0.lmol/L的下列五种溶液的pH值如表所示:
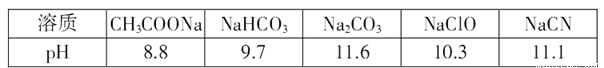
①根据表中数据,将浓度均为0.01 mol/L的下列四种酸的溶液分别稀释100倍,pH变化最小的是_____
A HCN B HClO C H2CO3 D CH3COOH
②根据以上数据,判断下列反应可以成立的是________。
A CH3COOH+Na2CO3=NaHCO3+CH3COONa B CH3COOH+NaCN=HCN+CH3COONa
C CO2 +H2O+ 2NaClO=Na2CO3+2HClO D NaHCO3+HCN=NaCN+CO2 +H2O
(4)几种离子开始沉淀时的pH如下表:
离子 | Fe2+ | Cu2+ | Mg2+ |
pH | 7.6 | 5.2 | 10.4 |
当向含相同浓度离子Cu2+、Fe2+、Mg2+的溶液中滴加NaOH溶液时,_________(填离子符号)先沉淀。
(5)电解质水溶液中存在电离平衡、水解平衡,请回答下列问题。
(1)已知部分弱酸的电离平衡常数如下表:
弱酸 | HCOOH | HCN | H2CO3 |
电离平衡常数(25 ℃) | Ka=1.77×10-4 | Ka=5.0×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
①同浓度HCOONa、NaCN、NaHCO3、Na2CO3这4种溶液中碱性最强的是__________;
②体积相同、c(H+