题目内容
【题目】氧化还原反应原理在生产生活和科学研究中应用广泛。
(1)下列表述中没有氧化还原反应发生的是_____。
a.滴水成冰 b.蜡炬成灰 c.百炼成钢
(2)NH3和Cl2反应的方程式为:NH3+Cl2﹣N2+HCl
①该反应中被氧化的元素是_____(填元素名称),氧化剂是_____(填化学式)。
②配平该方程式:_____NH3+_____Cl2=_____N2+_____HCl
(3)“地康法”制氯气的反应原理图示如下:
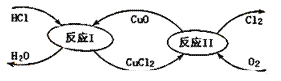
①反应I的化学方程式为_____。
②若要制得标准状况下氯气11.2L,则整个反应中转移电子的物质的量为_____。
【答案】a 氮 Cl2 2 3 1 6 2HCl+CuO=CuCl2+H2O 1mol
【解析】
(1)a、滴水成冰,没有生成新物质,属于物理变化,符合题意,a正确;
b.蜡炬燃烧生成二氧化碳和水,碳元素、氧元素化合价改变,属于氧化还原反应,与题意不符,b错误;
c.百炼成钢,为钢中的碳与氧气反应生成二氧化碳,碳元素、氧元素化合价改变,属于氧化还原反应,与题意不符,c错误;
(2)①还原剂化合价升高,被氧化,氧化剂化合价降低,被还原;
②利用化合价升降法配平;
(3)①根据反应原理图,反应I是HCl、CuO反应生成CuCl2和H2O;
②标准状况下11.2L氯气的物质的量是0.5mol,反应I是非氧化还原反应,反应II是氧化还原反应,氯元素化合价由﹣1升高为0。
(1)a、滴水成冰,没有生成新物质,属于物理变化,符合题意,a正确;
b.蜡炬燃烧生成二氧化碳和水,碳元素、氧元素化合价改变,属于氧化还原反应,与题意不符,b错误;
c.百炼成钢,为钢中的碳与氧气反应生成二氧化碳,碳元素、氧元素化合价改变,属于氧化还原反应,与题意不符,c错误;
故答案为a;
(2)①NH3和Cl2反应中氮元素化合价由﹣3升高为0,氯元素化合价由0降低为﹣1,该反应中被氧化的元素是氮元素,氧化剂是Cl2;
②氮元素化合价由﹣3升高为0,氯元素化合价由0降低为﹣1,最小公倍数为6,根据得失电子守恒配平方程式是2NH3+3Cl2=N2+6HCl;
(3)①根据反应原理图,反应I是HCl、CuO反应生成CuCl2和H2O,反应方程式是2HCl+CuO=CuCl2+H2O;
②标准状况下11.2L氯气的物质的量是0.5mol,反应I是非氧化还原反应,反应II是氧化还原反应,根据2CuCl2+O2=2CuO+2Cl2,氯元素化合价由﹣1升高为0,所以生成0.5mol氯气转移1mol电子。