题目内容
【题目】根据要求完成下列各小题实验.(a、b为弹簧夹,加热及固定装置已略去)

(1)验证碳、硅非金属性的相对强弱。(已知酸性:亚硫酸>碳酸)
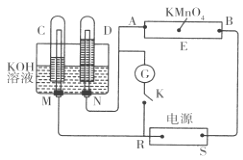
① 实验步骤:连接仪器、 、加药品后,打开a关闭b,然后滴入浓硫酸,加热;
② 铜与浓硫酸反应的化学方程式 ,装置A中的试剂是 ;
③ 能说明碳的非金属性比硅强的实验现象是 ;
(2)验证SO2的氧化性、还原性和酸性氧化物的通性。
① 在(1)②操作后打开b,关闭a ;
② H2S溶液中有浅黄色浑浊出现,化学方程式是 ;
③ BaCl2溶液中无明显现象,将其分成两份,分别滴加下列溶液,将产生的沉淀的化学式填入下表中相应位置。

写出其中SO2显示还原性生成沉淀的离子方程式 。
【答案】(1)检验装置的气密性 ;Cu + 2H2SO4(浓)![]() CuSO4 +SO2↑+2H2O ; 酸性的KMnO4溶液 ;A中KMnO4溶液没有完全褪色;盛有Na2SiO3溶液的试管中出现白色沉淀
CuSO4 +SO2↑+2H2O ; 酸性的KMnO4溶液 ;A中KMnO4溶液没有完全褪色;盛有Na2SiO3溶液的试管中出现白色沉淀
(2)2H2S+SO2=3S↓+2H2O

Ba2+ +SO2 +Cl2 +2H2O=BaSO4↓+4H+ +2Cl-
【解析】试题分析:(1)①装置A中反应制备气体,在加入药品之前需要检验装置的气密性;
②铜与浓硫酸反应生成硫酸铜和二氧化硫、水,所以反应的方程式为Cu + 2H2SO4(浓)![]() CuSO4 +SO2↑+2H2O;装置A的作用是除去二氧化硫,防止干扰二氧化碳与硅酸钠的反应,可以利用强氧化性物质如:酸性高锰酸钾溶液;
CuSO4 +SO2↑+2H2O;装置A的作用是除去二氧化硫,防止干扰二氧化碳与硅酸钠的反应,可以利用强氧化性物质如:酸性高锰酸钾溶液;
③利用较强酸制备较弱酸,酸性越强,最高价氧化物水化物的酸性越强,中心元素的非金属性越强,A中KMnO4溶液没有完全褪色,说明二氧化硫已经完全被氧化,盛有Na2SiO3溶液的试管中出现白色沉淀,说明碳的非金属性比硅强;
(2)②H2S溶液中二氧化硫与硫化氢反应生成硫单质与水,反应的化学方程式为2H2S+SO2=3S↓+2H2O;
③BaCl2溶液中无明显现象,将其分成两份,一份滴加氯水溶液,氯水中有氯气分子,氯气分子具有氧化性,能把二氧化硫氧化成+6价的硫酸根离子,硫酸根离子和钡离子反应生成硫酸钡白色沉淀,反应的方程式为Ba2+ +SO2 +Cl2 +2H2O=BaSO4↓+4H+ +2Cl-,另一份中滴加氨水,二氧化硫和水生成亚硫酸,亚硫酸和氨水反应生成亚硫酸铵,亚硫酸铵电离出氨根离子和亚硫酸根离子,亚硫酸根离子和钡离子反应生成亚硫酸钡沉淀。