题目内容
【题目】用下列实验装置进行相应实验,能达到实验目的是( )
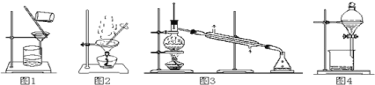
①用图1所示装置从Fe(OH)3胶体中过滤出Fe(OH)3胶粒
②用图2所示装置从氯化钠溶液中得到氯化钠晶体
③用图3所示装置从碘的四氯化碳溶液中分离出四氯化碳
④用图4所示装置从乙醇与苯的混合物中分离出苯
A.①②B.②③C.②③④D.①③④
【答案】B
【解析】
①胶体粒子能够透过滤纸,不能通过图1采用过滤的方法分离得到Fe(OH)3胶粒,①错误;
②NaCl的溶解度受温度的影响变化不大,所以从氯化钠溶液中得到氯化钠晶体可以采用图2的蒸发结晶的方法,②正确;
③碘与CCl4是互溶的沸点不同的物质,可以选用图3的蒸馏方法分离,③正确;
④乙醇与苯互溶,但沸点不同的液体混合物,可以采用图3的蒸馏方法,不能采用图4的分液方法分离,④错误;
可见分离混合物方法正确的是②③,故合理选项是B。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】雾霾天气严重影响人们的生活和健康。其中首要污染物为可吸入颗粒物PM2.5,其主要来源为燃煤、机动车尾气等。因此改善能源结构、机动车限号等措施能有效减少PM2.5、SO2、NOx等污染。请回答下列问题:
(1)将一定量的某PM2.5样品用蒸馏水溶解制成待测试样(忽略OH-)。常温下测得该试样的组成及其浓度如下表:根据表中数据判断该试样的pH=___________。
离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
浓度(mol·L-1) | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
(2)汽车尾气中NOx和CO的生成:
已知汽缸中生成NO的反应为:N2(g)+O2(g) ![]() 2NO(g) ΔH>0。恒温,恒容密闭容器中,下列说法中,能说明该反应达到化学平衡状态的是____。
2NO(g) ΔH>0。恒温,恒容密闭容器中,下列说法中,能说明该反应达到化学平衡状态的是____。
A.混合气体的密度不再变化 B.混合气体的压强不再变化
C.N2、O2、NO的物质的量之比为1∶1∶2 D.氧气的转化率不再变化
(3)为减少SO2的排放,可洗涤含SO2的烟气。下列可作为洗涤含SO2烟气的洗涤剂是 ___________。
A.NaHCO3饱和溶液 B.FeCl2饱和溶液 C.酸性CaCl2饱和溶液
(4)汽车使用乙醇汽油并不能减少NOx的排放,这使NOx的有效消除成为环保领域的重要课题。某研究性小组在实验室以Ag-ZSM-5为催化剂,测得NO转化为N2的转化率随温度变化情况如图所示。若不使用CO,温度超过775K,发现NO的分解率降低,其可能的原因为___________________________________,在n(NO)/n(CO)=1的条件下,为更好的除去NOx物质,应控制的最佳温度在_____K左右。

(5)车辆排放的氮氧化物、煤燃烧产生的二氧化硫是导致雾霾天气的“罪魁祸首”。活性炭可处理大气污染物NO。在5L密闭容器中加入NO和活性炭(假设无杂质),一定条件下生成气体E和F。当温度分别在T1℃ 和T2℃时,测得各物质平衡时物质的量(n/mol)如下表:
物质 温度℃ | 活性炭 | NO | E | F |
初始 | 3.000 | 0.100 | 0 | 0 |
T1 | 2.960 | 0.020 | 0.040 | 0.040 |
T2 | 2.975 | 0.050 | 0.025 | 0.025 |
①写出NO与活性炭反应的化学方程式____________________ (E,F均用化学式表示)。
②若T1<T2,则该反应的ΔH___________0。(填“>”“<”或“=”)
③计算上述反应T1℃时的平衡常数K=__________________。




