题目内容
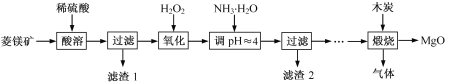
【题目】水钴矿中除SiO2外,还有9.24%CoO、2.78%Fe2O3、0.96%MgO、0.084%CaO。从中提取钴的主要工艺流程如下:
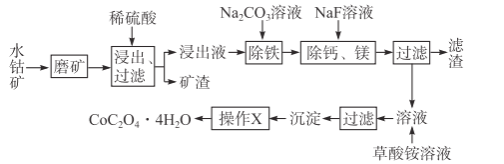
(1)浸出过程中,CoO溶解的离子反应方程式为___,矿渣的主要成分是___、___。
(2)请配平下列除铁的化学方程式:
_Fe2(SO4)3+_H2O+_Na2CO3=_Na2Fe6(SO4)4(OH)12↓+_Na2SO4+_CO2↑
(3)除钙、镁过程中,逐渐加入NaF溶液,当CaF2开始沉淀时,溶液中![]() =___。[已知Ksp(CaF2)=1.0×10-10、Ksp(MgF2)=7.4×10-11]。
=___。[已知Ksp(CaF2)=1.0×10-10、Ksp(MgF2)=7.4×10-11]。
(4)“操作X”是___。进行该操作的主要目的是除去沉淀中的杂质离子,检验杂质中的主要阴离子是否除净的试剂是___。
(5)100t水钴矿最多可获得___tCoC2O44H2O产品。
【答案】CoO+2H+=Co2++H2O SiO2 CaSO4 3 6 6 1 5 6 0.74 洗涤、干燥 BaCl2溶液 27.0
【解析】
水钴矿磨矿可将矿石粉碎,增大接触面积,加快反应速率,加入稀硫酸浸取过滤,滤液中含有:CoSO4、Fe2(SO4)3、MgSO4、CaSO4,矿渣为SiO2,、CaSO4;加入碳酸钠,除去Fe2(SO4)3,加入氟化钠,除去钙离子、镁离子,过滤得的滤液主要含CoSO4,加入草酸铵,通过沉淀、过滤、洗涤、干燥得到四水合草酸钴;
(1)氧化钴与硫酸反应生成硫酸钴和水;
(2)根据质量守恒定律即化学反应前后原子的种类和数目不变配平该方程式;
(3)已知Ksp(CaF2)=1.0×10-10、Ksp(MgF2)=7.4×10-11,因此逐渐加入NaF溶液过程中,先沉淀镁离子,后沉淀钙离子,当CaF2开始沉淀时,MgF2已经沉淀,则所得滤液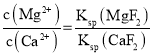 ;
;
(4)得到的沉淀要进行洗涤和干燥才能得到较纯净、干燥的物质;该沉淀吸附易溶于水的离子,根据流程图知,加入硫酸、碳酸钠、草酸铵的过程,溶液中引入硫酸根离子、铵根离子和钠离子,则杂质中的主要阴离子是硫酸根离子,根据硫酸根离子的检验选择试剂;
(5)根据Co元素守恒进行计算。
(1)水钴矿中除SiO2外,还有9.24%CoO,2.78%Fe2O3,0.96%MgO、0.084%CaO,加入稀硫酸溶解的是氧化铁、氧化镁、氧化钙、氧化钴,氧化钴溶解于硫酸反应的离子方程式为:CoO+2H+=Co2++H2O,二氧化硅不溶,生成的硫酸钙微溶,所以残渣为SiO2、CaSO4;
故答案为:CoO+2H+=Co2++H2O;SiO2;CaSO4;
(2)根据质量守恒定律即化学反应前后原子的种类和数目不变配平,首先根据Fe守恒,右边6个Fe,所以给Fe2(SO4)3前配3,在根据S守恒,给Na2SO4前配9-4=5,再根据Na守恒,给Na2CO3前配![]() ,最后根据C、H、O守恒配平方程式即可,所以其方程为3Fe2(SO4)3+6H2O+6Na2CO3=Na2Fe6(SO4)4(OH)12↓+5Na2SO4+6CO2↑;
,最后根据C、H、O守恒配平方程式即可,所以其方程为3Fe2(SO4)3+6H2O+6Na2CO3=Na2Fe6(SO4)4(OH)12↓+5Na2SO4+6CO2↑;
故答案为:3;6;6;1;5;6;
(3)已知Ksp(CaF2)=1.0×10-10、Ksp(MgF2)=7.4×10-11,因此逐渐加入NaF溶液过程中,先沉淀镁离子,后沉淀钙离子,当CaF2开始沉淀时,MgF2已经沉淀,则所得滤液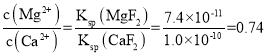 ;
;
故答案为:0.74;
(4)得到的沉淀要进行洗涤和干燥才能得到较纯净、干燥的物质;该沉淀吸附易溶于水的离子,根据流程图知,加入硫酸、碳酸钠、草酸铵的过程,溶液中引入硫酸根离子、铵根离子和钠离子,则杂质中的主要阴离子是硫酸根离子,检验硫酸根离子是否除尽的试剂是BaCl2溶液,取最后一次洗涤液于试管中,向其中滴加适量的BaCl2溶液,若无白色沉淀生成,说明阴离子硫酸根离子除净,沉淀洗涤干净;
故答案为:洗涤、干燥;BaCl2溶液;
(5)水钴矿中有9.24%CoO,则100t水钴矿中CoO质量=100t×9.24%=9.24t,依据钴元素守恒,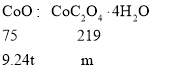
则可得比例式,![]() ,解得m=27.0t;
,解得m=27.0t;
故答案为:27.0。