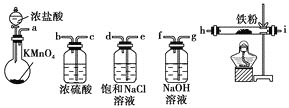
题目内容
【题目】已知A、B、C、D、E五种元素的原子序数依次增大,其中A原子所处的周期数、族序数都与其原子序数相等;B原子核外电子有6种不同的运动状态,s轨道电子数是p轨道电子数的两倍;D原子L电子层上有2对成对电子;![]() 原子核外有3层电子且各层均处于全满状态。
原子核外有3层电子且各层均处于全满状态。
(1)E元素基态原子的价电子排布式为__。
(2)B、C、D三种元素的第一电离能数值由小到大的顺序为__(填元素符号),电负性数值由大到小的顺序为__(填元素符号)。
(3)B元素的最高价氧化物对应的水化物中心原子采取的轨道杂化方式为__,C元素的气态氢化物的VSEPR模型为__。B2A4是重要的基本石油化工原料,1molB2A4分子中含__molσ键。写出与BD2为等电子体关系的分子、阳离子、阴离子各一个__、__、__。
(4)E单质晶胞的形成方式为图1中的哪一种:__(填ABA或ABC),其空间利用率为__。
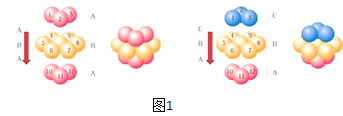
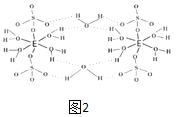
(5)E的硫酸盐结构如图2,此化合物是__(写名称),在图中画出以E为中心原子的配位键___。
【答案】3d104s1 C<O<N O>N>C sp2 四面体 5 CS2 NO2+ SCN-或N3- ABC 74% 五水硫酸铜 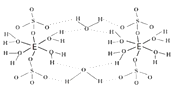
【解析】
A、B、C、D、E五种元素的原子序数依次增大,A原子所处的周期数、族序数都与其原子序数相等,则A为H元素;B原子核外电子有6种不同的运动状态,s轨道电子数是p轨道电子数的两倍,则B原子核外有6个电子,则B为C元素;D原子L层上有2对成对电子,则D原子电子排布式为![]() ,所以D为O元素;C的原子序数介于碳、氧元素之间,则C为N元素;
,所以D为O元素;C的原子序数介于碳、氧元素之间,则C为N元素;![]() 原子核外有3层电子且各层均处于全满状态,则E原子核外电子数为
原子核外有3层电子且各层均处于全满状态,则E原子核外电子数为![]() ,则E为Cu元素。
,则E为Cu元素。
(1)E为Cu元素,基态原子的核外电子排布式为:![]() ,则其基态原子的价电子排布式为:
,则其基态原子的价电子排布式为:![]() ,故答案为:
,故答案为:![]() ;
;
(2)同周期,随原子序数增大元素第一电离能呈增大趋势,但氮元素2p能级为半满稳定状态,能量较低,失去第一个电子需要的能量较多,其第一电离能高于同周期相邻元素,故C、N、O三种元素的第一电离能数值由小到大的顺序为![]() ;
;
非金属性越强,其电负性越强,非金属性:![]() ,则C、N、O三种元素的电负性大小为:
,则C、N、O三种元素的电负性大小为:![]() ,故答案为:
,故答案为:![]() ;
;![]() ;
;
(3)B元素的最高价氧化物对应的水化物是碳酸,碳酸中中心原子价层电子对个数是3且不含孤电子对,根据价层电子对互斥理论知,C原子杂化方式为![]() ;
;
C为N元素,其氢化物是![]() ,氨气分子中N原子价层电子对个数是4且含有1个孤电子对,VSEPR模型为四面体结构;
,氨气分子中N原子价层电子对个数是4且含有1个孤电子对,VSEPR模型为四面体结构;
1个![]() 分子中含有5个
分子中含有5个![]() 键,1个
键,1个![]() 键,则
键,则![]() 分子中含有
分子中含有![]() 键;
键;
与![]() 互为等电子体的分子、离子中含有3个原子,16个价电子,所以其等电子体的分子、阳离子、阴离子的化学式依次为:
互为等电子体的分子、离子中含有3个原子,16个价电子,所以其等电子体的分子、阳离子、阴离子的化学式依次为:![]() 、
、![]() 、
、![]() 或
或![]() ,
,
故答案为:![]() ;四面体; 5;
;四面体; 5;![]() ;
;![]() ;
;![]() 或
或![]() ;
;
(4)E为铜元素,Cu为面心六方密堆积,为ABC型方式堆积,其其空间利用率为![]() ,
,
故答案为:ABC;![]() ;
;
(5)该盐为硫酸铜,根据图2可知,该化合物分子中含有5个结晶水分子,为无水硫酸铜;该配合物中,铜原子提供空轨道,水中氧原子提供孤电子对,配位键由提供孤电子对的原子指向提供空轨道的原子,所以以Cu为中心原子的配位键为: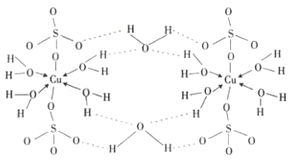 ,
,
故答案为:五水硫酸铜; 。
。

 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案【题目】现有部分元素的性质与原子![]() 或分子
或分子![]() 结构如表所示:
结构如表所示:
元素编号 | 元素性质与原子 |
T | 最外层电子数是次外层电子数的3倍 |
X | 常温下单质分子为双原子分子,分子中含有3对共用电子对 |
Y | M层比K层少1个电子 |
Z | 第三周期元素的金属离子中半径最小 |
(1)画出元素T的原子结构示意图:__。
(2)元素Y与元素Z相比,金属性较强的是__![]() 用元素符号表示
用元素符号表示![]() ,下列表述中能证明这一事实的是___
,下列表述中能证明这一事实的是___![]() 填字母
填字母![]() 。
。
a.Y单质的熔点比Z单质低
b.Y的化合价比Z低
c.Y单质与水反应比Z单质与水反应剧烈
d.Y最高价氧化物对应的水化物的碱性比Z的强
(3)T、X、Y、Z中的两种元素能形成既有离子键又有非极性共价键的化合物,写出该化合物的化学式:__。
(4)T可以形成稳定的阴离子Tm-,Y可以形成稳定的阳离子Yn+,其半径关系为r(Tm-)__r(Yn+)(填“>”,“<”或“=”)
(5)X、Y、Z的最高价氧化物对应的水化物可以相互发生反应,写出Y、Z的最高价氧化物对应的水化物之间反应的离子方程式___。