题目内容
6.短周期主族元素A、B、C、D,原子序数依次增大.A、C的原子序数的差为8,A、B、C三种元素原子的最外层电子数之和为15,B原子最外层电子数等于A原子最外层电子数的一半.下列叙述正确的是( )| A. | 单质B常温下能溶于浓硝酸 | |
| B. | A的氢化物沸点高于C的氢化物,因为A的非金属性比C强 | |
| C. | C、D形成的化合物CD2分子中各原子都满足8电子稳定结构 | |
| D. | 元素A与C形成的化合物CA2的水溶液中通入D单质充分反应后,溶液酸性减弱 |
分析 短周期主族元素A、B、C、D原子序数依次增大,B原子最外层电子数等于A原子最外层电子数的一半,则A原子最外层电子数为偶数,A、C的原子序数的差为8,则A、C为同主族元素,A、B、C三种元素原子的最外层电子数之和为15,令B原子最外层电子数为x,则x+2x+2x=15,解的x=3,故A、C的最外层电子数为6,A为O元素,C为S元素,B的原子序数大于氧元素,最外层电子数为3,故B为Al元素,D的原子序数最大,故D为Cl元素,据此解答.
解答 解:短周期主族元素A、B、C、D原子序数依次增大,B原子最外层电子数等于A原子最外层电子数的一半,则A原子最外层电子数为偶数,A、C的原子序数的差为8,则A、C为同主族元素,A、B、C三种元素原子的最外层电子数之和为15,令B原子最外层电子数为x,则x+2x+2x=15,解的x=3,故A、C的最外层电子数为6,A为O元素,C为S元素,B的原子序数大于氧元素,最外层电子数为3,故B为Al元素,D的原子序数最大,故D为Cl元素,
A、B为铝元素,铝在常温下遇到浓硝酸会发生钝化,故A错误;
B、A为O元素,C为S元素,A的氢化物沸点高于C的氢化物,因为水分子间存在氢键,故B错误;
C、C、D形成的化合物SCl2分子,S的最外层6个电子形成2个共用电子对后满足8电子稳定结构,Cl的最外层7个电子形成1个共用电子对后满足8电子稳定结构,故C正确;
D、元素A与C形成的化合物SO2的水溶液中通入氯气,会生成硫酸和HCl,溶液酸性增强,故D错误;
故选C.
点评 本题考查结构位置性质关系,难度中等,注意利用奇偶性及A、C的原子序数相差8判断二者处于同一主族(短周期),是推断元素关键.

练习册系列答案
相关题目
7.下列表示丙基的是( )
| A. | CH3CH2CH3 | B. | CH3CH2CH2- | C. | -CH2CH2- | D. | CH3- |
17.Cyrneine A对治疗神经系统疾病有着很好的疗效.可用香芹酮经过多步反应合成:

下列说法正确的是( )

下列说法正确的是( )
| A. | 香芹酮化学式为C9H12O | |
| B. | Cyrneine A可以发生加成反应、消去反应和氧化反应 | |
| C. | 香芹酮和Cyrneine A均能使酸性KMnO4溶液褪色 | |
| D. | 与香芹酮互为同分异构体,分子中有4种不同化学环境的氢原子的酚类化合物共有4种 |
14.下列化学用语书写正确的是( )
| A. | 氯原子的结构示意图: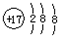 | B. | 氯化铵的电子式: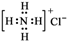 | ||
| C. | CO2的结构式:O=C=O | D. | CH4的比例模型: |
1.某有机物6.4g在氧气中完全燃烧,仅生成8.8gCO2和7.2gH2O.下列说法正确的是( )
| A. | 该化合物中C、H原子数之比为1:2 | |
| B. | 无法确定其分子式 | |
| C. | 分子式可以确定,但官能团类别无法确定 | |
| D. | 该化合物属于烃的衍生物 |
11.制备乙酸乙酯的装置如图所示,有关实验室制取乙酸乙酯的说法正确的是( )


| A. | 试剂添加的顺序为硫酸一乙醇一乙酸 | |
| B. | 无论怎样控制反应条件,1mol乙酸与1mol乙醇反应都不会生成1mol乙酸乙酯 | |
| C. | 试管B中盛有饱和氢氧化钠溶液来除去乙酸乙酯中的杂质,反应后可用分液方法分离 | |
| D. | 生成的乙酸乙酯和硬脂酸甘油酯互为同系物,都可以发生水解反应 |
15.下列物质既能与强酸又能够与强碱反应,且反应后都能产生气体的是( )
| A. | 碳酸氢铵 | B. | 亚硫酸氢钾 | C. | 碳酸氢钠 | D. | 硫酸氢铵 |
16.根据表中维生素C的有关信息,回答下列问题
(1)小明同学在超市中购买了以下食品:苹果、西红柿、薯片、牛肉干,上述食品中,富含维生素C的是苹果、西红柿;
(2)维生素C是一种水溶性维生素,其水溶液显酸性(填“酸”或“碱”),服用补铁(Fe2+)制剂时医生常建议同时服用维生素C,这是因为维生素C具有还原(填“氧化”或“还原”)性;生吃新鲜蔬菜要比熟吃时维生素C的损失小,因为维生素C在受热时很容易被氧化 (填“氧化”或“还原”);
(3)维生素C对于治疗下列哪种疾病比较有效A.
A.坏血病 B.脑炎 C.骨折 D.肺炎.
| 分子式 | C6H806 |
| 物理特性 | 可口酸味 |
| 化学特性 | 还原性,易被氧化 |
| 重要功能 | 抗坏血病 |
| 主要存在 | 新鲜水果,绿色蔬菜 |
(2)维生素C是一种水溶性维生素,其水溶液显酸性(填“酸”或“碱”),服用补铁(Fe2+)制剂时医生常建议同时服用维生素C,这是因为维生素C具有还原(填“氧化”或“还原”)性;生吃新鲜蔬菜要比熟吃时维生素C的损失小,因为维生素C在受热时很容易被氧化 (填“氧化”或“还原”);
(3)维生素C对于治疗下列哪种疾病比较有效A.
A.坏血病 B.脑炎 C.骨折 D.肺炎.

 .
. +2nNaOH→n
+2nNaOH→n +(n+1)H2O.
+(n+1)H2O.