��Ŀ����
��CH4����ԭNOx�������������������Ⱦ������
��CH4(g)+4NO2(g)��4NO(g)+CO2(g)+2H2O(g)����H=��574kJ/mol
��CH4(g)+4NO(g) ��2N2(g)+CO2(g)+2H2O(g)����H=��1160kJ/mol������˵������ȷ����
�� A���ɷ�Ӧ�ٿ���֪��CH4(g)+4NO2(g)��4NO(g)+CO2(g)+2H2O(l)����H=��Q kJ/mol��Q��574
�� B�������ʵ����ļ���ֱ�μӷ�Ӧ�١��ڣ���Ӧת�Ƶĵ�������ͬ
�� C�����ñ�״����4.48LCH4��ԭNO2��N2���ų�������Ϊ173.4kJ
�� D�����ñ�״����4.48LCH4��ԭNO2��N2������������ת�Ƶĵ�������Ϊ1.6mol
���𰸡�
B
����������

��ϰ��ϵ�д�
 ����Ӣ��ϵ�д�
����Ӣ��ϵ�д�
�����Ŀ
 ��2010?������һģ��һ����̼����������͵�����������Ҫ�Ļ���ԭ�ϣ���Ҳ�Ǵ�������Ҫ��Ⱦ��ۺ���������Ⱦ�ǻ�����ѧ��ǰ����Ҫ�о�����֮һ��
��2010?������һģ��һ����̼����������͵�����������Ҫ�Ļ���ԭ�ϣ���Ҳ�Ǵ�������Ҫ��Ⱦ��ۺ���������Ⱦ�ǻ�����ѧ��ǰ����Ҫ�о�����֮һ��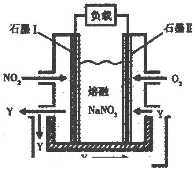
 ������ȼ������ʱ�����ĸ��»�����N2��O2������Ӧ����NO���壬�ǵ�������β���к���NO��ԭ��֮һ��
������ȼ������ʱ�����ĸ��»�����N2��O2������Ӧ����NO���壬�ǵ�������β���к���NO��ԭ��֮һ�� ���Ŵ�����Ⱦ���������أ��������ڡ�ʮ���塱�ڼ䣬����������SO2���ŷ�������8%���������NOx���ŷ�������10%��Ŀǰ������������Ⱦ�ж��ַ�����
���Ŵ�����Ⱦ���������أ��������ڡ�ʮ���塱�ڼ䣬����������SO2���ŷ�������8%���������NOx���ŷ�������10%��Ŀǰ������������Ⱦ�ж��ַ�����