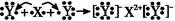题目内容
下表是元素周期表的一部分, 针对表中的①~⑩种元素,填写下列空白:
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 1 | ① | | | |||||
| 2 | | | | ② | ③ | ④ | | |
| 3 | ⑤ | | ⑥ | | ⑦ | | ⑧ | ⑨ |
| 4 | ⑩ | | | | | | | |
(1)写由上述元素组成的分子中电子总数为10的分子(至少两种): 。
(2)比较:②、③、④、⑤的第一电离能: > > > (写元素符号)。
(3)在最高价氧化物的水化物中,酸性最强的化合物的分子式是 ;碱性最强的化合物的电子式是:
(4)具有两性的最高价氧化物是 (填化学式);写出其与氢氧化钠溶液反应的离子方程式: 。
(5)下表为原子序数依次增大的短周期元素A~E的第一到第五电离能数据。
| 电离能I(eV) | A | B | C | D | E |
| I1 | 11.3 | 13.6 | 5.2 | 7.6 | 6.0 |
| I2 | 24.4 | 35.1 | 49.3 | 15.0 | 18.8 |
| I3 | 47.9 | 54.9 | 71.6 | 80.1 | 28.4 |
| I4 | 64.5 | 77.4 | 98.9 | 109.2 | 112.0 |
| I5 | 392.1 | 113.9 | 138.3 | 141.3 | 153.7 |
试回答:表中可能为非金属元素的是 (填字母);若D、E为同周期相邻元素,表中D比E的第一电离能略大,其原因是 。
(1)CH4 NH3 H2O (任写两种)。
(2)N>O>C> Na (写元素符号)。
(3)HClO4 KOH电子式:
(4)Al2O3 Al2O3 +2OH- =2AlO 2-+H2O。
(5)A B; D的P轨道全空,能量更低更稳定。
解析试题分析:(1)①~⑩元素分别是H、C、N、O、Na、Al、P、Cl、Ar、K,由元素组成的分子中电子总数为10的分子有CH4 NH3 H2O HF等
(2)②、③、④、⑤元素分别是C、N、O、Na,根据电离能的递变规律,N最外层半充满,第一电离能最大,Na的电子层数最多,第一电离能最小,O、C位居其中,所以第一电离能的大小顺序为N>O>C > Na
(3)元素的非金属性越强,其最高价含氧酸的酸性越强,所以酸性最强是酸是氯元素对应的高氯酸,化学式为HClO4,金属性越强,其最高价氧化物的水化物的碱性越强,所以碱性最强的碱是KOH,其电子式为
(4)具有两性的最高价氧化物是Al2O3;其与氢氧化钠溶液反应的离子方程式:Al2O3 +2OH- =2AlO 2-+H2O
(5)非金属元素的第一电离能比较大,通过表中数据可以判断第一电离能较大的为非金属元素,AB可能属于非金属;E的前三电离能较小,第四电离能突然增大,说明此元素的化合价为+3,为铝元素,而D的第一电离能比E略大且相邻,所以D为镁,原因是镁的p轨道全空,能量更低更稳定
考点:考查元素周期表、元素周期律的应用,电子式、化学式、离子方程式的书写,元素电离能的应用

 考前必练系列答案
考前必练系列答案下表为元素周期表的一部分,请回答有关问题:
| | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | | | | | ① | ② | ③ | |
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | |
(1)表中最活泼的金属是 ,非金属性最强的元素是 (填写元素符号)。
(2)表中能形成两性氢氧化物的元素名称是 ,写出该元素的氢氧化物与④的最高价氧化物对应水化物反应的离子方程式: 。
(3)元素⑨和元素⑩的最高价氧化物的水化物中酸性较强是 (用化学式表示)。
(4)元素⑩与元素⑤形成的化合物属于 (填 “共价”或“离子”)化合物。
(5)请画出元素②的原子结构示意图为 ,元素①的单质在常温下化学性质稳定,通常可以做保护气,请用电子式表示其分子 。
X、Y、Z、W是元素周期表前四周期中常见的元素,其相关信息见下表:
| 元素 | 相关信息 |
| X | X的基态原子核外的三个能级上电子数相等 |
| Y | Y与X同周期,Y基态原子p能级的成对电子数与未成对电子数相等 |
| Z | Z的单质是一种银白色活泼金属,在空气中燃烧后生成淡黄色的固体 |
| W | 向含W2+的溶液中滴加强碱,其白色氢氧化物在空气中迅速变成灰绿色,最后变成红褐色 |
(1)W位于周期表的第______周期_____族,其基态原子最外层有________个电子。
(2)X的最简单氯化物分子呈____________型结构, Z在空气中燃烧生成的淡黄色的固体中含有的化学键类型____________________。
(3)若将金属Z投入含WCl3的溶液中,发生反应的离子方程式为____________________。
(4)工业上冶炼W过程涉及以下两个热化学方程式:
3W2Y3(s)+XY(g) =2W3Y4(s)+XY2(g) △H=-15.73kJ/mol
W3Y4(s)+XY (g) =" 3WY" (s)+XY 2(g) △H= +640.4kJ/mol
则反应W2Y3 (s)+XY (g) =" 2" WY (s)+XY 2(g) 的△H= _________________ 。
元素周期表是学习化学的重要工具,它隐含着许多信息和规律。下表所列是五种短周期元素的原子半径及主要化合价(已知铍的原子半径为0.089 nm)。
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.16 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +2 | +3 | +6,-2 | -1 | -2 |
(1)用元素代号标出它们在周期表中的对应位置(以下为周期表的一部分)。
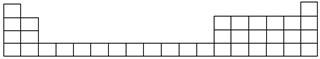
(2)B元素处于周期表中________周期________族。
(3)B的最高价氧化物的水化物与C的最高价氧化物的水化物反应的离子方程式为______________________________________________。
(4)上述五种元素的最高价氧化物对应水化物中酸性最强的是________(填化学式)。
(5)C、E形成的化合物为________(填化学式)。
下列关于元素周期律和元素周期表的论述中正确的是( )。
| A.同一主族的元素从上到下金属性逐渐减弱 |
| B.元素周期表是元素周期律的具体表现形式 |
| C.同一周期从左到右,元素原子半径逐渐增大 |
| D.非金属元素的最高正化合价等于它的负化合价的绝对值 |
 化合物一
化合物一 最高价氧化物
最高价氧化物 ,已知该元素的原子核中中子数和质子数相等,则该元素的名称是________。
,已知该元素的原子核中中子数和质子数相等,则该元素的名称是________。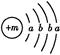 ,X的阳离子与Y的阴离子的电子层结构相同。元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子。
,X的阳离子与Y的阴离子的电子层结构相同。元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子。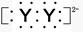
 2Y-+Z↓
2Y-+Z↓