题目内容
短周期主族元素A、B、C、D、E的原子序数依次增大,它们原子核外的电子层数之和为10;B元素的化合物种类繁多,数目庞大.C、D两种元素形成的单质是空气中含量最多的物质;D、E两元素可以生成两种不同的离子化合物.(1)由A、C、D三元素所形成常见盐A4C2D3的溶液呈______性(填“酸”、“中”、“碱”),其原因用离子方程式表示为:______.
(2)B的相对分子质量最小的氢化物的燃烧热为890.3kJ?mol-1,写出其燃烧的化学方程式______.
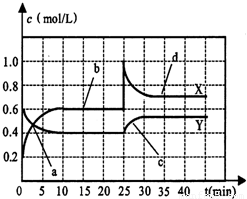
(3)X、Y是均由C、D两元素组成的化合物,且C、D在X、Y中的价态相同,某温度下在2L的密闭容器中X、Y相互转化时的量变关系如图:
①该反应的化学方程式为______
②反应进行到25min时,改变的条件可能是______
A、缩小容器体积 B、充入0.4molNO2
C、充入0.4molN2O4 D、充入0.8molNO2
③30min后反应再次达到平衡,此时,Y转化为X的化学平衡常数为______(填数值).
④若反应温度不变,在2L的密闭容器中充入1.4molY,反应达平衡后Y的转化率是______.
【答案】分析:B元素的化合物种类繁多,数目庞大,B为C元素,C、D两种元素形成的单质是空气中含量最多的物质,为O2和N2,根据原子序数依次增大,则C为N元素,D为O元素,D、E两元素可以生成两种不同的离子化合物,则E为Na元素,根据它们原子核外的电子层数之和为10,则A为H元素,
(1)A、C、D三元素所形成常见盐A4C2D3,应为NH4NO3,铵根离子水解呈酸性;
(2)B的相对分子质量最小的氢化物为CH4;
(3)①由图象可以判断出在10min内a、b物质的量变化的比值为1:2,且a的物质的量减小,则a为N2O4,为反应物,b的物质的量增多,为生成物;
②在25min的瞬间,NO2的物质的量突然增大,而N2O4的物质的量不变,则应是充入NO2;
③30min后反应再次达到平衡,此时温度不变,平衡常数不变;
④若反应温度不变,平衡常数不变,利用平衡常数计算.
解答:解:B元素的化合物种类繁多,数目庞大,B为C元素,C、D两种元素形成的单质是空气中含量最多的物质,为O2和N2,根据原子序数依次增大,则C为N元素,D为O元素,D、E两元素可以生成两种不同的离子化合物,则E为Na元素,根据它们原子核外的电子层数之和为10,则A为H元素;
(1)A、C、D三元素所形成常见盐A4C2D3,应为NH4NO3,铵根离子水解呈酸性,反应的离子方程式为NH4++H2O NH3?H2O+H+,
NH3?H2O+H+,
故答案为:酸;NH4++H2O NH3?H2O+H+;
NH3?H2O+H+;
(2)B的相对分子质量最小的氢化物为CH4,燃烧热为890.3kJ?mol-1,反应生成稳定的氧化物,热化学方程式为CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3KJ/mol,
故答案为:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3KJ/mol;
(3)①X、Y是均由C、D两元素组成的化合物,且C、D在X、Y中的价态相同,应为N2O4和NO2,由图象可以判断出在10min内a、b物质的量变化的比值为1:2,且a的物质的量减小,则a为N2O4,为反应物,b的物质的量增多,为生成物,则反应为N2O4 2NO2,
2NO2,
故答案为:N2O4 2NO2;
2NO2;
②在25min的瞬间,NO2的物质的量突然增大,而N2O4的物质的量不变,则应是充入NO2,如缩小体积,则二者的浓度都应增大,故答案为:D;
③30min后反应再次达到平衡,此时温度不变,平衡常数不变,与10min时的平衡常数相同,则k= =0.9,
=0.9,
故答案为:0.9;
④若反应温度不变,在2L的密闭容器中充入1.4molN2O4,反应达平衡后设转化的N2O4的物质的量为xmol,
N2O4 2NO2
2NO2
起始:1.4mol 0
转化:x 2x
平衡:(1.4mol-x) 2x
根据温度不变平衡常数不变可知: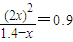 ,x=0.47mol,反应达平衡后Y的转化率是
,x=0.47mol,反应达平衡后Y的转化率是 =
= ,
,
故答案为: .
.
点评:本题考查较为综合,题目难度较大,本题关键为正确推断元素的种类,并利用平衡常数计算.
(1)A、C、D三元素所形成常见盐A4C2D3,应为NH4NO3,铵根离子水解呈酸性;
(2)B的相对分子质量最小的氢化物为CH4;
(3)①由图象可以判断出在10min内a、b物质的量变化的比值为1:2,且a的物质的量减小,则a为N2O4,为反应物,b的物质的量增多,为生成物;
②在25min的瞬间,NO2的物质的量突然增大,而N2O4的物质的量不变,则应是充入NO2;
③30min后反应再次达到平衡,此时温度不变,平衡常数不变;
④若反应温度不变,平衡常数不变,利用平衡常数计算.
解答:解:B元素的化合物种类繁多,数目庞大,B为C元素,C、D两种元素形成的单质是空气中含量最多的物质,为O2和N2,根据原子序数依次增大,则C为N元素,D为O元素,D、E两元素可以生成两种不同的离子化合物,则E为Na元素,根据它们原子核外的电子层数之和为10,则A为H元素;
(1)A、C、D三元素所形成常见盐A4C2D3,应为NH4NO3,铵根离子水解呈酸性,反应的离子方程式为NH4++H2O
 NH3?H2O+H+,
NH3?H2O+H+,故答案为:酸;NH4++H2O
 NH3?H2O+H+;
NH3?H2O+H+;(2)B的相对分子质量最小的氢化物为CH4,燃烧热为890.3kJ?mol-1,反应生成稳定的氧化物,热化学方程式为CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3KJ/mol,
故答案为:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3KJ/mol;
(3)①X、Y是均由C、D两元素组成的化合物,且C、D在X、Y中的价态相同,应为N2O4和NO2,由图象可以判断出在10min内a、b物质的量变化的比值为1:2,且a的物质的量减小,则a为N2O4,为反应物,b的物质的量增多,为生成物,则反应为N2O4
 2NO2,
2NO2,故答案为:N2O4
 2NO2;
2NO2;②在25min的瞬间,NO2的物质的量突然增大,而N2O4的物质的量不变,则应是充入NO2,如缩小体积,则二者的浓度都应增大,故答案为:D;
③30min后反应再次达到平衡,此时温度不变,平衡常数不变,与10min时的平衡常数相同,则k=
 =0.9,
=0.9,故答案为:0.9;
④若反应温度不变,在2L的密闭容器中充入1.4molN2O4,反应达平衡后设转化的N2O4的物质的量为xmol,
N2O4
 2NO2
2NO2起始:1.4mol 0
转化:x 2x
平衡:(1.4mol-x) 2x
根据温度不变平衡常数不变可知:
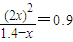 ,x=0.47mol,反应达平衡后Y的转化率是
,x=0.47mol,反应达平衡后Y的转化率是 =
= ,
,故答案为:
 .
.点评:本题考查较为综合,题目难度较大,本题关键为正确推断元素的种类,并利用平衡常数计算.

练习册系列答案
相关题目
短周期主族元素A、B、C、D的原子序数依次增大.A、C原子序数相差8,A、B、C三种元素原子的最外层电子数之和为15,B原子最外层电子数等于A原子最外层电子数的一半.下列叙述正确的是( )
| A、原子半径:A<D<C<B | B、B、C、D分别与A形成的化合物一定含有相同的化学键 | C、最高价氧化物对应水化物的酸性:D<C | D、常温下,单质B能大量溶于浓硝酸中 |
短周期主族元素A、B、C的原子序数依次递增,A与C同主族,B原子的最外层电子数等于A原子的次外层电子数,它们原子的最外层电子数之和为10,则下列叙述正确的是( )
| A、原于半径A<B<C | B、A的气态氢化物稳定性大于C的气态氢化物稳定性 | C、A、C两元素最高价氧化物均可与水化合得到对应的酸 | D、高温时,A单质可以从C的氧化物中置换得到C单质 |
短周期主族元素A、B、C、D、E的原子序数依次增大,其中A与C同主族,A与其它元素不在同一周期,B与D同主族,常温下D的单质为淡黄色固体.下列推断中正确的是( )
| A、原子半径由小到大的顺序:r(C)<r(D)<r(E) | B、元素D、E分别与A形成的化合物的热稳定性:E>D | C、元素D的最高价氧化物对应水化物的酸性比E的强 | D、元素B分别与A、C形成的化合物中化学键的类型完全相同 |
 短周期主族元素A、B、C、D、E的原子序数依次增大,它们原子核外的电子层数之和为10;B元素的化合物种类繁多,数目庞大.C、D两种元素形成的单质是空气中含量最多的物质;D、E两元素可以生成两种不同的离子化合物.
短周期主族元素A、B、C、D、E的原子序数依次增大,它们原子核外的电子层数之和为10;B元素的化合物种类繁多,数目庞大.C、D两种元素形成的单质是空气中含量最多的物质;D、E两元素可以生成两种不同的离子化合物. NH3?H2O+H+
NH3?H2O+H+ 2NO2
2NO2