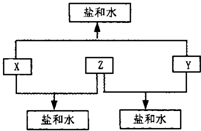
题目内容
已知:①A、B、C、D四种物质均含有元素X,可能还含有元素Y或Z.元素Y、X、Z的原子序数依次递增且不超过20.②X在A、B、C、D中的化合价分别为0、-1、+1、+5.③室温下单质A与某种常见一元强碱溶液反应,可得到B和C.④化合物D在二氧化锰催化下受热分解,可制得元素Y的单质.请回答下列问题:
(1)写出元素X、Y、Z的元素符号:X:
(2)写出A、B、C、D的化学式:A
(3)画出Y原子的结构示意图
 ;写出③中反应的化学方程式
;写出③中反应的化学方程式
(4)写出④中反应的化学方程式
(5)制得元素Y的单质,若收集到标准状况下6.72LY单质气体,至少需要多少克化合物D?同时生成氯化物的物质的量为多少mol?(用涉及到的化学式写出计算步骤)
(1)写出元素X、Y、Z的元素符号:X:
Cl
Cl
,Y:O
O
,ZK
K
.(2)写出A、B、C、D的化学式:A
Cl2
Cl2
,BNaCl
NaCl
,CNaClO
NaClO
,DKClO3
KClO3
.(3)画出Y原子的结构示意图


Cl2+2NaOH=NaCl+NaClO+H2O
Cl2+2NaOH=NaCl+NaClO+H2O
.(4)写出④中反应的化学方程式
2KClO3
2KCl+3O2 ↑
| ||
| △ |
2KClO3
2KCl+3O2 ↑
.实验室通过反应④制得元素Y的单质后,如何将产物分离并分别获得纯净物?写出实验步骤:
| ||
| △ |
(5)制得元素Y的单质,若收集到标准状况下6.72LY单质气体,至少需要多少克化合物D?同时生成氯化物的物质的量为多少mol?(用涉及到的化学式写出计算步骤)
分析:(1)在二氧化锰催化下受热分解,可制得单质可知D为KClO3,Y为O,,-1价的短周期元素且有变价的元素X为Cl,元素Y、X、Z的原子序数依次递增且不超过20,Z为K;
(2)Cl2+2NaOH=NaCl+NaClO+H2O,化合物D在二氧化锰催化下受热分解,可制得元素Y的单质可知D为KClO3;
(3)根据氧原子结构示意图及Cl2与NaOH反应方程式解题;
(4)KClO3在二氧化锰催化下受热分解,将产物溶于水后过滤;
(5)根据方程式进行计算.
(2)Cl2+2NaOH=NaCl+NaClO+H2O,化合物D在二氧化锰催化下受热分解,可制得元素Y的单质可知D为KClO3;
(3)根据氧原子结构示意图及Cl2与NaOH反应方程式解题;
(4)KClO3在二氧化锰催化下受热分解,将产物溶于水后过滤;
(5)根据方程式进行计算.
解答:解:(1)化合物D在二氧化锰催化下受热分解,可制得元素Y的单质可知D为KClO3,Y为O,,X在A、B、C、D中的化合价分别为0、-1、+1、+5,-1价的短周期元素且有变价的元素X为Cl,元素Y、X、Z的原子序数依次递增且不超过20,Z为K,故答案为:Cl;O;K;
(2)单质A为Cl2,Cl2与某种常见一元强碱溶液反应,可得到BNaCl和CNaClO,化合物D在二氧化锰催化下受热分解,可制得元素Y的单质可知D为KClO3,
故答案为:Cl2 ;NaCl;NaClO;KClO3;
(3)氧原子最外层6个电子,原子结构示意图为 ,Cl2与NaOH反应生成NaCl,NaClO,H2O;
,Cl2与NaOH反应生成NaCl,NaClO,H2O;
故答案为: ;Cl2+2NaOH=NaCl+NaClO+H2O;
;Cl2+2NaOH=NaCl+NaClO+H2O;
(4)KClO3在二氧化锰催化下受热分解,将反应后的混合物溶于水后过滤,故答案为:2KClO3
2KCl+3O2 ↑;
将反应后的混合物二氧化锰,KCl溶于水后过滤,二氧化锰不溶于水为滤渣,KCl可溶于水为滤液,对滤液蒸发结晶可得KCl;
(5)n(O2 )=
=0.3moL,
设需要X克化合物KClO3,同时生成氯化物的物质的量为Ymol
2KClO3
2KCl+3O2 ↑
122.5g 2moL 3mol
X Y 0.3mol
=
=
解得:X=12.25g,Y=0.2mol,
答:需要12.25g化合物KClO3,同时生成氯化物的物质的量为0.2mol.
(2)单质A为Cl2,Cl2与某种常见一元强碱溶液反应,可得到BNaCl和CNaClO,化合物D在二氧化锰催化下受热分解,可制得元素Y的单质可知D为KClO3,
故答案为:Cl2 ;NaCl;NaClO;KClO3;
(3)氧原子最外层6个电子,原子结构示意图为
 ,Cl2与NaOH反应生成NaCl,NaClO,H2O;
,Cl2与NaOH反应生成NaCl,NaClO,H2O;故答案为:
 ;Cl2+2NaOH=NaCl+NaClO+H2O;
;Cl2+2NaOH=NaCl+NaClO+H2O; (4)KClO3在二氧化锰催化下受热分解,将反应后的混合物溶于水后过滤,故答案为:2KClO3
| ||
| △ |
将反应后的混合物二氧化锰,KCl溶于水后过滤,二氧化锰不溶于水为滤渣,KCl可溶于水为滤液,对滤液蒸发结晶可得KCl;
(5)n(O2 )=
| 6.72L |
| 22.4moL/L |
设需要X克化合物KClO3,同时生成氯化物的物质的量为Ymol
2KClO3
| ||
| △ |
122.5g 2moL 3mol
X Y 0.3mol
| 122.5g |
| X |
| 3moL |
| 0.3moL |
| 2moL |
| Y |
解得:X=12.25g,Y=0.2mol,
答:需要12.25g化合物KClO3,同时生成氯化物的物质的量为0.2mol.
点评:本题考查元素及化合物的推断,化学方程式的计算,难度适中.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
H2和I2在一定条件下能发生反应:H2(g)+I2(g)?2HI(g)△H=-a kJ?mol-1
已知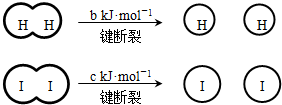 (a、b、c均大于零)
(a、b、c均大于零)
下列说法不正确的是( )
已知
 (a、b、c均大于零)
(a、b、c均大于零)下列说法不正确的是( )
| A、反应物的总能量高于生成物的总能量 | B、断开1mol H-H键和1mol I-I键所需能量大于断开2mol H-I键所需能量 | C、断开2mol H-I键所需能量约为(c+b+a)kJ | D、向密闭容器中加入2mol H2和2mol I2,充分反应后放出的热量小于2a kJ |

 已知:A、B、C、D、E、F、X为周期表中前四周期的七种元素,它们的原子序数依次增大.A是周期表中原子半径最小的元素;B的基态原子有3个不同的能级,各能级中电子数相等;D的基态原子2p能级上的未成对电子数与B原子的相同;D2-离子与E2+离子具有相同的稳定电子层结构;F有“生物金属”之称,F4+离子和氩原子的核外电子排布相同;X的基态原子的价电子排布式为3d84s2.
已知:A、B、C、D、E、F、X为周期表中前四周期的七种元素,它们的原子序数依次增大.A是周期表中原子半径最小的元素;B的基态原子有3个不同的能级,各能级中电子数相等;D的基态原子2p能级上的未成对电子数与B原子的相同;D2-离子与E2+离子具有相同的稳定电子层结构;F有“生物金属”之称,F4+离子和氩原子的核外电子排布相同;X的基态原子的价电子排布式为3d84s2.
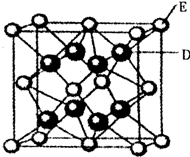 已知:A、B、C、D、E、F是周期表中前36号元素,A是原子半径最小的元素,B元素基态原子的2P轨道上只有两个电子,C元素的基态原子L层只有2对成对电子,D是元素周期表中电负性最大的元素,E2+的核外电子排布和Ar原子相同,F的核电荷数是D和E的核电荷数之和.
已知:A、B、C、D、E、F是周期表中前36号元素,A是原子半径最小的元素,B元素基态原子的2P轨道上只有两个电子,C元素的基态原子L层只有2对成对电子,D是元素周期表中电负性最大的元素,E2+的核外电子排布和Ar原子相同,F的核电荷数是D和E的核电荷数之和.