题目内容
【题目】铜及其化合物在生产生活中有着广泛的用途。
(1)基态铜原子的核外电子排布式为_____________。其晶体的堆积方式为__________________,
其中铜原子的配位数为_____________。
(2)向硫酸铜溶液中滴氨水,首先形成蓝色沉淀;继续滴加氨水,沉淀溶解,得到深蓝色的透明溶液;继续向溶液中加入乙醇,会析出深蓝色晶体[Cu(NH3)4SO4·H2O]。
①氨水中各元素原子的电负性由大到小的顺序为_______________(用元素符号表示)。
②NH3中N原子的杂化轨道类型为_____________,与其互为等电子体的阳离子为__________。
③向蓝色沉淀中继续滴加氨水,沉淀溶解是因为生成了四氨合铜络离子,四氨合铜络离子的结构式
为____________;加入乙醇后析出晶体的原因为________________。
(3) CuCl2和CuCl是铜的两种常见的氯化物。
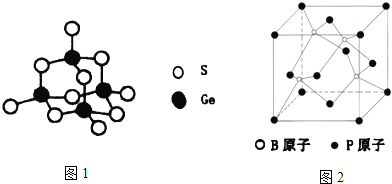
①下图表示的是________________ (填“CuCl2”或“CuCl”)的晶胞。
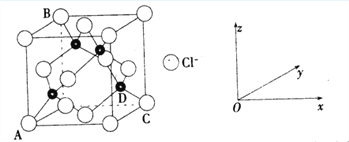
②原子坐标参数,表示晶胞内部各原子的相对位置,上图中各原子坐标参数A为(0,0,0);B为(0,1,1);C为(1,1,0);则D原子的坐标参数为____________。
③上图晶胞中C、D两原子核间距为298 pm,阿伏伽德罗常数为NA,则该晶体密度为______g·cm-3(列出计算式即可)。
【答案】 ls22s22p63s23p63d104s1 面心立方最密堆积 12 O>N>H sp3 H3O+ 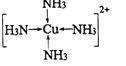 降低溶剂极性,使Cu(NH3)4SO4H2O析出(合理答案即可) CuCl (
降低溶剂极性,使Cu(NH3)4SO4H2O析出(合理答案即可) CuCl (![]() ,
, ![]() ,
, ![]() )
) 
【解析】(1)铜的核电荷数为29,其基态铜原子的核外电子排布式为ls22s22p63s23p63d104s1;其晶体的堆积方式为面心立方最密堆积,其中铜原子的配位数为12;
(2)①氨水中存在的元素为H、N、O,元素的非金属性越强,电负性越大,则三种元素的电负性由大到小的顺序为O>N>H;
②NH3分子中N原子呈3个N-H键,N原子还原1对孤对电子对,杂化轨道数为4,N原子采取sp3杂化;与NH3分子互为等电子体的一种微粒具有相同的价电子数8和原子数4,阳离子微粒为H3O+;
③[Cu(NH3)4]2+为配合物,Cu2+为中心离子,电荷数为+2,NH3为配体,配位数为4,其结构式为 ;加入乙醇的目的是为了降低溶剂极性,使Cu(NH3)4SO4H2O析出;
;加入乙醇的目的是为了降低溶剂极性,使Cu(NH3)4SO4H2O析出;
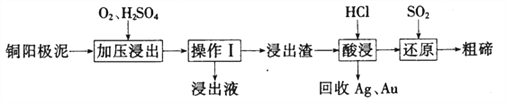
(3)①晶胞中Cl-的个数为8![]() +6
+6![]() =4,Cu的个数为4,则化学式为CuCl,属于CuCl的晶胞;
=4,Cu的个数为4,则化学式为CuCl,属于CuCl的晶胞;
②D与周围4个原子形成正四面体结构,D与顶点C的连线处于晶胞体对角线上,且DC间距离为对角线的![]() 处,则D原子的坐标参数为(
处,则D原子的坐标参数为(![]() ,
, ![]() ,
, ![]() );
);
③已知一个晶胞中含有4个CuCl,设晶胞的边长为a,则CD间距离为![]() a,则a=
a,则a=![]() pm,则晶胞的体积为a3,晶胞的密度为
pm,则晶胞的体积为a3,晶胞的密度为![]() =
=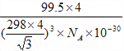 g/cm3。
g/cm3。
点晴:考查电负性及与金属性非金属性的关系等,清楚主族元素电负性的递变规律是解题关键,电负性表示对键合电子的吸引力,电负性越大对键合电子吸引力越大,所以非金属性越强电负性越强,故电负性最强的物质在周期表的右上角(零族元素除外);同周期自左而右电负性增大,同主族自上而下电负性降低,非金属性越强电负性越强,故金属性越强电负性越小。

 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案【题目】现有反应:Na2S2O3+H2SO4=Na2SO4+SO2+S↓+H2O,下列各组实验中最先出现浑浊的 ( )
实验 | 反应温度/℃ | Na2S2O3溶液 | 稀H2SO4 | H2O | ||
V/mL | c/(molL﹣1) | V/mL | c/(molL﹣1) | V/mL | ||
A | 25 | 5 | 0.1 | 10 | 0.1 | 5 |
B | 25 | 5 | 0.2 | 5 | 0.2 | 10 |
C | 35 | 5 | 0.1 | 10 | 0.1 | 5 |
D | 35 | 5 | 0.2 | 5 | 0.2 | 10 |
A.A
B.B
C.C
D.D
【题目】下列为元素周期表中的一部分,用化学式或元素符号回答下列问题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
二 | ⑥ | ⑦ |
| |||||
三 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
四 | ② | ④ | ⑨ |
(1) 11种元素中,化学性质最不活泼的是________。(填元素符号,下同)
(2) ①②⑤中,最高价氧化物对应的水化物碱性最强的是________。(填对应的碱)
(3) ②③④中形成的简单离子半径由大到小的顺序是________________________。(填离子)
(4) 元素⑦的氢化物分子式为________,该氢化物与元素⑧的单质反应的离子方程式是______ 。
(5) ①和⑨的最高价氧化物对应的水化物的化学式为__________和________。①和⑨两元素形成化合物的化学式为____,该化合物的水溶液与元素⑧的单质反应的离子方程式为__________。
(6) ①和⑤最高价氧化物对应的水化物相互反应的化学方程式为________________。
(7) ⑧⑨![]() 三种元素形成的气态氢化物最稳定的是______________________。
三种元素形成的气态氢化物最稳定的是______________________。