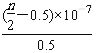题目内容
【题目】碲(Te)为第VIA元素.其单质和化合物在化工生产等方面具有重要应用。
(1)TeO2微溶于水,易溶于较浓的强酸和强碱。与盐酸反应时生成四氯化碲,其化学方程式为________________。
(2)25℃时;亚碲酸(H2TeO3)的 Ka1=1×10-3,Ka2=2×10-8。该温度下,0.1mol·L-1 H2TeO3的电离度α约为______________(α=![]() ×100%);NaHTeO3溶液的pH__________7(填“ >”、“<”或“=”)。
×100%);NaHTeO3溶液的pH__________7(填“ >”、“<”或“=”)。
(3)工业上常用铜阳极泥(主要成分为Cn2Te,还含有少量的Ag、Au)为原料制备单质碲,其工艺流程如下:
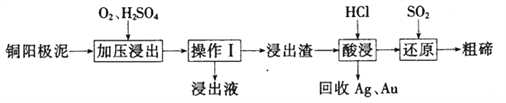
①实验室进行操作I时,下列仪器与该实验操作无关的为__________(填选项字母)。
A.长颈漏斗 B.烧杯 C.锥形瓶 D .玻璃棒
②已知‘浸出渣”的主要成分为TeO2。“加压浸出”时控制溶液pH为4.5~5.0,酸性不能过强的原因为_______________;“加压浸出”过程的离子方程式为______________________。
③“酸浸”后将SO2通入浸出液即可制得单质碲,则生成碲的化学方程式为________________。
④工业上还可以将铜阳极泥煅烧、碱浸后得到Na2TeO3,然后通过电解的方法得到单质碲。已知电解时的电极均为石墨,则阴极的电极反应式为___________。
【答案】TeO2 + 4HCl = TeCl4 + 2H2O10%<AC溶液酸性过强,TeO2会继续与酸反应导致碲元素损失Cu2Te+ 2O2+ 4H+ = 2Cu2+ + TeO2+ 2H2OTeCl4+2SO2+4H2O=Te↓+4HCl+2H2SO4TeO32-+ 3H2O+ 4e-=Te+ 6OH-
【解析】(1 )TeO2微溶于水,溶于盐酸时生成四氯化碲和水,发生反应的化学方程式为TeO2 + 4HCl = TeCl4 + 2H2O;
⑵亚碲酸(H2TeO3)为二元弱酸,其一级电离为主,H2TeO3的电离度为α,
H2TeO3![]() HTeO3-+H+
HTeO3-+H+
起始浓度(mol/L) 0.1 0 0
起始浓度(mol/L) 0.1α 0.1α 0.1α
起始浓度(mol/L) 0.1(1-α) 0.1α 0.1α
Ka1=1×10-3=![]() ,解得:α=10%;
,解得:α=10%;
已知Ka2=2×10-8,则HTeO3-的水解常数Kb=![]() =(1×10-14)÷(2×10-8)=0.5×10-6<Ka1,故HTeO3-的电离大于其水解,NaHTeO3溶液显酸性,pH<7;
=(1×10-14)÷(2×10-8)=0.5×10-6<Ka1,故HTeO3-的电离大于其水解,NaHTeO3溶液显酸性,pH<7;
(3)①操作I为过滤操作,所需要的仪器为漏斗、烧杯、玻璃棒,则下列仪器中长颈漏斗及锥形瓶与此操作无关,答案为AC;
②TeO2能溶解于较浓的强酸性或强碱性溶液,故“加压浸出”时控制溶液pH为4.5~5.0,的酸性不能过强,否则TeO2会继续与酸反应导致碲元素损失;“加压浸出”过程中用硫酸溶解Cu2Te的离子方程式为Cu2Te+ 2O2+ 4H+ = 2Cu2+ + TeO2+ 2H2O;
③用盐酸溶解TeO2后后溶液中存在TeCl4,将SO2通入浸出液即可制得单质碲,同时SO2发生氧化反应,得到硫酸,结合氧化还原反应中电子守恒规律,则生成碲的化学方程式为TeCl4+2SO2+4H2O=Te↓+4HCl+2H2SO4;
④用惰性电极电解Na2TeO3,阴极发生还原反应生成单质碲,其电极反应式为TeO32-+ 3H2O+ 4e-=Te+ 6OH-。

 习题精选系列答案
习题精选系列答案