题目内容
【题目】氮及其化合物广泛存在于自然界中,回答下列问题:
(1)在基态16N中,其s能电子云形状是_____形的,其p能级轨道上存在______个自旋方向相同的电子;CN-中共价键的类型有______。
(2)碱性肥料氰氮化钙(CaCN2)的组成元素第一电离能最小的是_______(填名称)。
(3)化合物(CH3)3N能溶于水,其原因是_______________,(CH3)3N与盐酸反应生成[(CH3)3NH]+,该过程新生成的化学键类型为__________________.。
(4)阳离子[(CH3)3NH]+和阴离子A可按个数比4:1组成化合物,阴离子A的结构如图1所示,则S原子的杂化轨道类型是______,阴离子A的化学式为______。

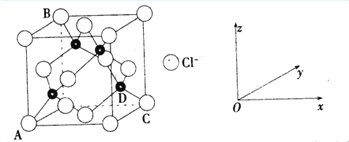
(5)立方氮化硼的晶胞如图2所示(白球为氮原子,黑球为硼原子),则硼原子的配位数为______;若晶胞边长为acm,则立方氮化硼的密度是______g·cm-3(只要求列算式,阿伏伽德罗常数用NA表示)。
【答案】球3α键π键钙(CH3)3N为极性分子且能与水分子形成氢键配位键sp3(2分) [Ge4Sp]4-4![]()
【解析】(1)在基态16N的电子排布式为1s22s22p3,轨道表达式为![]() ;其s能电子云形状均为球形的,其p能级轨道上存在3个自旋方向相同的电子;CN-中存在碳氮三键,则有1个 α键和2个π键;
;其s能电子云形状均为球形的,其p能级轨道上存在3个自旋方向相同的电子;CN-中存在碳氮三键,则有1个 α键和2个π键;
(2)Ca为金属,C、N为非金属性,故Ca的第一电离能最小;;
(3)极性分子(CH3)3N和水之间形成氢键,所以溶解性增强,且二者均为极性分子,相似相溶,化合物(CH3)3N与盐酸反应生成[(CH3)3NH]+,氢离子含有空轨道,N原子含有孤对电子,该过程新生成的化学键为氮与质子氢离子形成配位键;
(4)阳离子[(CH3)3NH]+和阴离子A可按个数比4:1组成化合物,阴离子A中含有4个Ge和10个S,结合电中性可知阴离子为[Ge4S10]4-,结构中6个S原子形成2个共价键,还含有2个孤对电子,其中4个S只形成一个共价键,则还要得到一个电子才能形成8电子稳定结构,含有3对孤电子对,杂化轨道数目均为4,属于sp3杂化;
(5)B原子与周围的4个N原子形成正四面体结构,B原子的配位素为4;若晶胞边长为acm,晶胞的体积为(acm)3,晶胞中P原子为8×![]() +6×
+6×![]() =4,N原子为4,则晶胞中含有4个BN,NA个晶胞的质量为4×25g=100g;晶胞的密度为
=4,N原子为4,则晶胞中含有4个BN,NA个晶胞的质量为4×25g=100g;晶胞的密度为![]() =
=![]() g/cm3。
g/cm3。