题目内容
【题目】(1)A、B、C、D、E、G均为元素周期表前四周期元素,原子序数依次增大。A 元素原子核外电子分占3 个不同能级,且每个能级上排布的电子数相同;B 元素的简单气态氢化物与最高价氧化物的水化物反应生成盐;C 元素为非金属元素且基态原子的p 能级上电子数比s能级上电子数多1;D元素的原子序数等于B、C两元素原子序数之和,E 是前四周期元素中基态原子中含单电子数最多的元素;G元素位于周期表第11纵行。
(1)E属于____区的元素,其基态原子的核外电子排布式为_____________________。
(2)五种元素中,电负性最大的是__________________(填元素符号)。
(3)B与其同周期相邻元素第一电离能由大到小的顺序为____________________(用元素符号表示)。
(4)下图是已经合成的最著名的“D-B”化合物的分子结构。“D-B”化合物在研磨或迅速加热时会剧烈分解并引起爆炸,生成非常稳定的两种单质分子(相对分子质量之比为7:64),发生反应的化学方程式为____________。
(5)A 元素的最高价含氧酸根离子( 只含A 和氧两种元素)的空间构型为__________________,该酸根离子的中心原子的轨道杂化类型为________________________,与该酸根离子互为等电子体的一种分子为______(填化学式)。
(6)已知G 与C1元素的某种化合物的晶胞结构如图所示: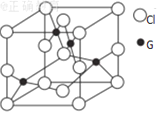 则该化合物的化学式是__________,若G 与Cl原子最近的距离为a cm,则该晶体的密度为_________g·cm-3(只要求列算式,不必计算出数值,阿伏加德罗常数的数值为NA)。
则该化合物的化学式是__________,若G 与Cl原子最近的距离为a cm,则该晶体的密度为_________g·cm-3(只要求列算式,不必计算出数值,阿伏加德罗常数的数值为NA)。
【答案】 d 1s22s22p63s23p63d54s1(或[Ar]3d54s1) F N>O>C 2S4N4 ![]() 4N2↑+S8 平面三角形 sp2 SO3(或BF3或BC13等) CuCl
4N2↑+S8 平面三角形 sp2 SO3(或BF3或BC13等) CuCl 
【解析】(1)A、B、C、D、E、G均为元素周期表前四周期元素,原子序数依次增大。B元素的简单气态氢化物与最高价氧化物的水化物反应生成盐,B为氮元素;A元素原子核外电子分占3个不同能级,且每个能级上排布的电子数相同,排布为1s22s22p2,A为碳元素;C元素为非金属元素且基态原子的p能级上电子数比s能级上电子数多1,C为氟元素; E是前四周期元素中基态原子中含单电子数最多的元素;E为铬元素;D元素的原子序数等于B、C两元素原子序数之和,D为硫元素;G元素位于周期表第11纵行,G为铜元素;所以:A、B、C、D、E、G六种元素分别为C、 N、 F、 S、 Cr、 Cu;
(1)根据以上分析可知E为铬元素,其基态原子的核外电子排布式为1s22s22p63s23p63d54s1(或[Ar]3d54s1),属于d 区元素;正确答案: d ; 1s22s22p63s23p63d54s1(或[Ar]3d54s1)。
(2)同一周期,从左到右,电负性增大,同一主族,从上到下,电负性减弱,因此电负性最大的为F;正确答案:F。
(3)非金属性越强,第一电离能越大,但由于氮元素的2p轨道电子处于半充满状态,稳定性强,则与氮元素同周期相邻元素第一电离能由大到小的顺序N>O>C;正确答案:N>O>C。
(4)“D-B”化合物在研磨或迅速加热时会剧烈分解并引起爆炸,生成非常稳定的单质A、单质B,A、B的相对分子质量之比为![]() ,氮气的相对分子质量为28,则B为
,氮气的相对分子质量为28,则B为![]() ,则B分子为
,则B分子为![]() ,由原子守恒可以知道该化学反应为2S4N4
,由原子守恒可以知道该化学反应为2S4N4 ![]() 4N2↑+S8 ;正确答案:2S4N4
4N2↑+S8 ;正确答案:2S4N4 ![]() 4N2↑+S8 。
4N2↑+S8 。
(5) 碳酸根的空间构型为平面三角形,中心碳原子采取了SP2杂化方式与氧原子成键,所有原子都在同一平面上。等电子体为原子总数相等,电子总数相等,因此与碳酸根离子互为等电子体的一种分子为SO3(或BF3或BC13等);正确答案:平面三角形; sp2 ; SO3(或BF3或BC13等)。
(6)晶胞中Cu位于顶点、面心,晶胞中Cu原子为![]() ,Cl原子位于晶胞内部,晶胞中Cl原子数目为4,故该晶体化学式为CuCl;晶胞质量为
,Cl原子位于晶胞内部,晶胞中Cl原子数目为4,故该晶体化学式为CuCl;晶胞质量为 原子与周围的4个Cu原子形成正四面体结构,Cl原子位于正四面体的中心,Cu原子位于正四面体的顶点,设正四面体的棱长为x cm,则正四面体的斜高为
原子与周围的4个Cu原子形成正四面体结构,Cl原子位于正四面体的中心,Cu原子位于正四面体的顶点,设正四面体的棱长为x cm,则正四面体的斜高为 ,底面中心到边的距离为
,底面中心到边的距离为 ,根据正四面体的体积及中心原子与得到形成的四面体的体积关系,可以知道正四面体的高与中心原子到底面距离之比为
,根据正四面体的体积及中心原子与得到形成的四面体的体积关系,可以知道正四面体的高与中心原子到底面距离之比为![]() ,即中心原子到顶点与底面距离之比为
,即中心原子到顶点与底面距离之比为![]() ,则正四面体的高为
,则正四面体的高为![]() ,由勾股定理:
,由勾股定理: ,整理的
,整理的 ,晶胞棱长为
,晶胞棱长为 ,故晶胞密度为
,故晶胞密度为 =
= ;正确答案:CuCl;
;正确答案:CuCl;  。
。