题目内容
2.某实验室从化学试剂商店买回密度为1.84g•cm3、质量分数为98%的“化学纯”硫酸.现用该浓硫酸配制90mL、1mol•L-1的稀硫酸.可供选用的仪器有:①胶头滴管;②烧瓶;③烧杯;④药匙;⑤量筒;⑥托盘天平.请回答下列问题:
(1)配制稀硫酸时,上述仪器中不需要使用的有②④⑥(选填序号),还缺少的仪器有玻璃棒、100mL容量瓶.
(2)配制100mL 1mol•L-1的稀硫酸需要上述浓硫酸的体积为5.4mL(保留一位小数),量取浓硫酸时应选用①(选填①10mL、②50mL、③100mL)规格的量筒.
(3)实验中造成所配溶液浓度偏高的原因可能是B.
A.容量瓶中原来含有少量蒸馏水
B.未经冷却,立即转移至容量瓶并洗涤烧杯,定容
C.烧杯没有洗涤
D.向容量瓶中加水定容时眼睛一直仰视刻度线.
分析 (1)用浓硫酸配制稀硫酸溶液需要的仪器有:玻璃棒、烧杯、量筒、胶头滴管、100mL容量瓶;
(2)根据稀释定律c1V1=c2V2计算需要浓硫酸的体积;根据“大而近”的原则,根据需要量取的浓硫酸的体积来选择合适的量筒;
(3)分析操作对溶质物质的量、溶液体积的影响,根据c=$\frac{n}{V}$判断对所配溶液浓度影响.
解答 解:(1)由于实验室无90mL容量瓶,故应选用100mL的容量瓶,即用浓硫酸配制稀硫酸溶液需要的仪器有:玻璃棒、烧杯、量筒、胶头滴管、100mL容量瓶,故不需要的是②④⑥,还需要的是玻璃棒、100mL容量瓶.
故答案为:②④⑥;玻璃棒、100mL容量瓶;
(2)由于实验室无90mL容量瓶,故应选用100mL的容量瓶,则配制出100mL1mol•L-1的稀硫酸.
浓硫酸的物质的量浓度C=$\frac{1000ρω}{M}$=$\frac{1000×1.84×98%}{98}$=18.4mol/L.
设配制100mL 1mol•L-1的稀硫酸需取浓硫酸的体积为V,根据稀释定律,则:
100mL×1mol/L=V mL×18.4mol/L,解得V=5.4mL;
根据“大而近”的原则,根据需要量取的浓硫酸的体积为5.4mL,故应选择10mL的量筒.故答案为:5.4,①;
(3)A.若容量瓶未干燥即用来配制溶液,对溶液浓度无影响,因为只要定容时正确,至于水是原来就有的还是后来加入的,对浓度无影响,故A不选;
B.未经冷却,立即转移至容量瓶并洗涤烧杯,定容,则冷却后溶液体积偏小,则浓度偏高,故B选;
C.烧杯没有洗涤,会造成溶质的损失,则浓度偏低,故C不选;
D.向容量瓶中加水定容时眼睛一直仰视刻度线,会导致溶液体积偏大,则浓度偏低,故D不选.
故选B.
点评 本题考查一定物质的量浓度溶液配制,难度中等,注意根据c=$\frac{n}{V}$理解溶液配制原理与误差分析.

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案| A. | CH2═CH2 | B. | CH3CH=CH2 | C. | 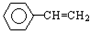 | D. | CO2 |
(3)2FeCl3+2HI=2FeCl2+I2+2HCl (4)I2+SO2+2H2O=H2SO4+2HI
判断下列微粒氧化性强弱顺序正确的是( )
| A. | Cl2>Fe3+>SO2>I2 | B. | Cl2>Fe3+>I2>SO2 | C. | Cl2>I2>Fe3+>SO2 | D. | Fe3+>I2>Cl2>SO2 |
| 成分 | 质量(g) | 摩尔质量(g•mol-1) |
| 蔗糖 | 50.00 | 342 |
| 硫酸钾 | 0.50 | 174 |
| 阿司匹林 | 0.35 | 180 |
| 高锰酸钾 | 0.50 | 158 |
| 硝酸银 | 0.04 | 170 |
A、蔗糖 B、硫酸钾 C、高锰酸钾 D、硝酸银
(2)“鲜花保鲜剂”中K+(阿司匹林中不含K+)的物质的量浓度为$\frac{0.50}{158}+\frac{2×0.50}{174}$ L•mol-1.(只要求写出计算表达式,不需要计算结果)
(3)配制上述1L“鲜花保鲜剂”所需的仪器有:1000mL容量瓶、烧杯、玻璃棒、药匙、胶头滴管、托盘天平.(在横线上填写所缺仪器的名称)
(4)在溶液配制过程中,下列操作对配制结果没有影响的是BD.
A、将药品放入容量瓶中加蒸馏水溶解
B、容量瓶在使用前未干燥,里面有少量蒸馏水
C、容量瓶在使用前刚刚配制完一定物质的量浓度的NaCl溶液而未洗净
D、定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理.
| A. | 3:2:1 | B. | 1:2:3 | C. | 3:1:1 | D. | 1:3:3 |
 某厂排出的废液主要含硝酸锌和硝酸银,为了从回收金属银和硝酸锌,某中学化学课外活动组设计了以下的实验步骤:
某厂排出的废液主要含硝酸锌和硝酸银,为了从回收金属银和硝酸锌,某中学化学课外活动组设计了以下的实验步骤: