题目内容
【题目】燃料电池是一种能量转换效率高、对环境友好的化学电源,如图为一种氢氧燃料电池的结构装置。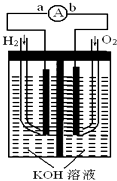
(1)电极b为该燃料电池的极(填“正”或“负”),电极方程式为;
(2)电池工作时,溶液中的OH﹣移向极(填“a”或“b”);
(3)电池工作时,在导线中电子流动方向为(用a、b表示);
(4)电池使用一段时间后,溶液的pH值(填“增大”或“减小”);
(5)当电池工作一段时间后消耗标准状况下H2 为6.72L时,转移电子 mol。
【答案】
(1)正,O2+2H2O+4e-=4OH
(2)a
(3)a流向b
(4)减少
(5)0.6
【解析】解:(1)电极b通入的是氧气,氧气在反应中得到电子,则b电极为该燃料电池的正极,电极方程式为O2+2H2O+4e-=4OH-;(2)a电极是负极,则电池工作时,溶液中的OH-移向a极;(3)电池工作时,在导线中电子流动方向为a流向b;(4)电池使用一段时间后,由于有水生成,则溶液的碱性降低,则pH值减小;(5)当电池工作一段时间后消耗标准状况下H2 为6.72L时,物质的量是6.72L÷22.4L/mol=0.3mol,则转移电子0.3mol×2=0.6mol。
本题考察燃料电池的相关问题,
若电解质溶液是碱
负极反应式为:![]() (液中的OH-移向,碱性降低,则pH值减小)
(液中的OH-移向,碱性降低,则pH值减小)
正极反应式为:![]()
氢气在电池的负极失去电子,这些电子沿着外电路的导线流动.内电路不是电流,而是离子的定向移动,阳离子移动到正极得到电子,阴离子移向负极,

【题目】X、Y、Z、W为四种短周期元素,其中Y元素原子核外最外层电子数是其电子层数的3倍,它们在周期表中的相对位置如图所示:
X | Y | |
Z | W |
请回答下列问题:
(1)W元素在周期表中的位置
(2)X、Y、Z、W分别形成的简单离子的半径由小到大的顺序为<<<(用化学式填写,下同);Y、Z对应的气态氢化物的稳定性> .
(3)在一定条件下,由元素Y和Z组成的一种气态化合物可发生催化氧化反应,反应达平衡时有三种气态物质共存,已知每转移4mol电子放热190.0kJ,该反应的热化学方程式为 .
(4)工业上将干燥的W单质通入熔融的Z单质中可制得化合物Z2W2 , 该物质可与水反应生成一种能使品红溶液褪色的气体,0.2mol该物质参加反应时转移0.3mol电子,其中只有一种元素化合价发生改变,写出Z2W2与水反应的化学方程式 .