题目内容
工业上电解饱和食盐水可产生氯气,氯气与石灰乳反应可制得漂白粉。若欲制得标准状况112L氯气,则求理论上消耗多少克食盐?用这些氯气理论上可生产漂白粉多少克?
585克 635克
解析试题分析:电解饱和食盐水发生的反应为:2NaCl+2H2O 2NaOH+H2↑+Cl2↑,制得的氯气的物质的量为
2NaOH+H2↑+Cl2↑,制得的氯气的物质的量为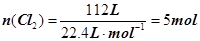 ,因为每生成1molCl2必消耗2molNaCl,所以消耗食盐的质量为
,因为每生成1molCl2必消耗2molNaCl,所以消耗食盐的质量为 ;氯气和Ca(OH)2反应可制得漂白粉(CaCl2和Ca(ClO)2的混合物):2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,CaCl2 的摩尔质量为111 g·mol–1,Ca(ClO)2的摩尔质量为143g·mol–1,则可生产漂白粉:(111g·mol–1+143g·mol–1)×5mol×
;氯气和Ca(OH)2反应可制得漂白粉(CaCl2和Ca(ClO)2的混合物):2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,CaCl2 的摩尔质量为111 g·mol–1,Ca(ClO)2的摩尔质量为143g·mol–1,则可生产漂白粉:(111g·mol–1+143g·mol–1)×5mol×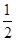 = 635g
= 635g
考点:考查物质的量在化学方程式计算中的应用。

练习册系列答案
相关题目
Na2O2曾经是潜水艇或航天器中最理想的供氧剂。下表是人体呼出气体的成分(均为体积百分含最)。
| | 空气 成分 | 人体呼出 气体成分 |
| N2 | 78% | 74% |
| O2 | 21% | 16% |
| H2O | 0. 5% | 6% |
| CO2 | 0. 03% | 4% |
(1)已知一个人一天大约要产生16 mol CO2。若全部被Na2O2吸收,需要Na2O2________ g。
(2)若要使被吸收的CO2与产生的O2体积相等,就需
要在Na2O2中添加KO2.计算要达到该目的.Na2O2与KO2的物质的量比例是 。
已知:4KO2+2CO2=2K2CO3+3O2
(3)计算100 L空气经过人体呼吸后,呼出气体中O2的体积(标准状况下,保留2位小数)____ L。
(4)为保持航天器中空气成分恒定,并充分利用资源,需对人体呼出的气体进行处 理,无用物质排出航天器。100 L空气经过人体呼吸后,欲使呼出的气体经过处理后恢复原空气成分且体积仍为100 L(可供使用的化学试剂只有Na2O2).通过计算回答:若先利用CO2,还需要利用水蒸气,求需要水蒸气体积 L。
下列化合物中,不属于有机物的是
| A.甲烷 | B.淀粉 | C.二氧化碳 | D.蔗糖 |
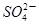 的物质的量浓度_____________mol/L;
的物质的量浓度_____________mol/L; Fe3O4 + nA↑+ 6S
Fe3O4 + nA↑+ 6S
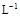 (NH4)2Fe(SO4)2 溶液充分反应,过量Fe2+再用0.0500 mol·
(NH4)2Fe(SO4)2 溶液充分反应,过量Fe2+再用0.0500 mol·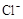 +5Fe3+ +2H2O
+5Fe3+ +2H2O 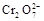 +6 Fe2+ =2Cr3+ + 6 Fe3+ +7H2O
+6 Fe2+ =2Cr3+ + 6 Fe3+ +7H2O