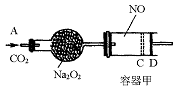
题目内容
以黄铁矿(FeS2)、氯酸钠和硫酸溶液混合反应制备二氧化氯气体,再用水吸收获得二氧化氯溶液。在此过程中需要控制适宜的温度,若温度不当,副反应增加,影响生成ClO2气体的纯度,且会影响ClO2气体的吸收率。具体情况如图6所示。请回答下列问题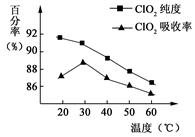
(1)据图可知,反应时需要控制的适宜温度是 ℃,达到此要求采取的适宜措施是 。
(2)已知:黄铁矿中的硫元素在酸性条件下被ClO3-氧化成SO42-,写出制备二氧化氯的离子方程式: 。
(3)某校化学学习小组拟以“m(ClO2)/m(NaClO3)”作为衡量ClO2产率的指标。若取NaClO3样品质量6.0g,通过反应和吸收可得400 mL ClO2溶液,取出20 mL,加入37.00 mL 0.500mol·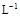 (NH4)2Fe(SO4)2 溶液充分反应,过量Fe2+再用0.0500 mol·
(NH4)2Fe(SO4)2 溶液充分反应,过量Fe2+再用0.0500 mol·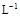 K2Cr2O7标准溶液滴定至终点,消耗20.00 mL。反应原理如下:
K2Cr2O7标准溶液滴定至终点,消耗20.00 mL。反应原理如下:
4H++ClO2+5Fe2+=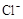 +5Fe3+ +2H2O
+5Fe3+ +2H2O
14H+ +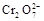 +6 Fe2+ =2Cr3+ + 6 Fe3+ +7H2O
+6 Fe2+ =2Cr3+ + 6 Fe3+ +7H2O
试计算ClO2的“产率”。(写出计算过程)
(12分)
(1)30℃(2分) 水浴加热(或水浴控制恒温)(2分)
(2)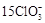 +FeS2+14H+ =15ClO2 ↑+ Fe3++7H2O+
+FeS2+14H+ =15ClO2 ↑+ Fe3++7H2O+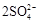 (2分)
(2分)
(3)与K2CrO7反应的n(Fe2+)=6n(Cr2O72-)=6×20×10-3 L × 0. 0500 mol/L=6×10-3 mol (2分)
与ClO2反应的n(Fe2+)=37×10-3 L×0.500 mol/L-6×10-3 mol =1.25×10-2 mol
n(ClO2)=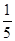 ×1.25×10-2 =2.5×10-3 mol (2分)
×1.25×10-2 =2.5×10-3 mol (2分)
ClO2的产率=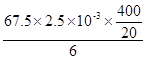 ×100%=56.25% (2分)
×100%=56.25% (2分)
解析试题分析:⑴由图可知,ClO2气体的吸收率30℃时最高,控制100℃以下可用水浴加热,故答案:30℃、水浴加热(或水浴控制恒温);⑵-1价的S被氧化在+6价,+2的Fe 被氧化成Fe3+ ,ClO3―被还原成ClO2,根据化合价升降法配平得方程式,答案: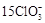 +FeS2+14H+ =15ClO2 ↑+ Fe3++7H2O+
+FeS2+14H+ =15ClO2 ↑+ Fe3++7H2O+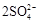 ;⑶基本计算,写清过程,注意单位,有效数字。答案为:与K2CrO7反应的n(Fe2+)=6n(Cr2O72-)=6×20×10-3 L × 0. 0500 mol/L=6×10-3 mol (2分)
;⑶基本计算,写清过程,注意单位,有效数字。答案为:与K2CrO7反应的n(Fe2+)=6n(Cr2O72-)=6×20×10-3 L × 0. 0500 mol/L=6×10-3 mol (2分)
与ClO2反应的n(Fe2+)=37×10-3 L×0.500 mol/L-6×10-3 mol =1.25×10-2 mol
n(ClO2)=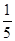 ×1.25×10-2 =2.5×10-3 mol (2分)
×1.25×10-2 =2.5×10-3 mol (2分)
ClO2的产率=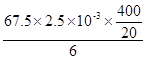 ×100%=56.25% (2分)
×100%=56.25% (2分)
考点:物质组成分析与化学综合计算题

 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案奶粉中蛋白质含量的测定往往采用“凯氏定氮法”,其原理是食品与硫酸和催化剂一同加热,使蛋白质分解,分解的氨与硫酸结合生成硫酸铵。然后碱化蒸馏使氨游离,用硼酸吸收后再以硫酸或盐酸标准溶液滴定,根据酸的消耗量乘以换算系数,即为蛋白质含量。
操作步骤:
①样品处理:准确称取一定量的固体样品奶粉,移入干燥的烧杯中,经过一系列的处理,待冷却后移入一定体积的容量瓶中。
②NH3的蒸馏和吸收:把制得的溶液(取一定量),通过定氮装置,经过一系列的反应,使氨变成硫酸铵,再经过碱化蒸馏后,氨即成为游离态,游离氨经硼酸吸收。
③氨的滴定:用标准盐酸溶液滴定所生成的硼酸铵,由消耗的盐酸标准液计算出总氮量,再折算为粗蛋白含量。
试回答下列问题:
(1)在样品的处理过程中使用到了容量瓶,怎样检查容量瓶是否漏水?
________________________________________________________________________________________________________________________________________________。
(2)在配制过程中,下列哪项操作可能使配制的溶液的浓度偏大( )
| A.烧杯中溶液转移到容量瓶中时,未洗涤烧杯 |
| B.定容时,俯视刻度线 |
| C.定容时,仰视刻度线 |
| D.移液时,有少量液体溅出 |
[已知:滴定过程中涉及到的反应方程式:(NH4)2B4O7+2HCl+5H2O===2NH4Cl+4H3BO3]
用密度为1.84g/cm3,质量分数为98%的浓硫酸配制100mL 1.00mol/L 的稀硫酸。
(1)在容量瓶的使用方法中,下列操作不正确的是____________
| A.使用容量瓶前检验是否漏水 |
| B.容量瓶用水洗净后,再用待配溶液洗涤 |
| C.配制溶液时,如果试样是固体,把称好的固体用纸条小心倒入容量瓶中,缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线。 |
| D.配制溶液时,若试样是液体,用量筒取样后用玻璃棒引流倒入容量瓶中,缓慢加水至刻度线1~2cm处, 用胶头滴管加蒸馏水至刻度线。 |
(2)经计算,上述浓硫酸的浓度为_______ mol/L。配制100mL1.00mol/L的稀硫酸,应用量筒量取浓硫酸的体积为_______mL(保留一位小数),量取时应选用_______ (填序号①10mL、②50mL 、③100mL)规格的量筒。
(3)请将下列步骤补充完整:
a.量取所需浓硫酸在烧杯中加适量蒸馏水溶解,待溶液冷却到室温后将其沿玻璃棒移入 mL的容量瓶中,并将洗涤液移入容量瓶中。
b.向容量瓶内加水,直到液面接近刻度线 cm时,改用 小心地加水至溶液凹液面与刻度线相切。
c.将容量瓶盖好瓶盖,摇匀。
(4)配制过程中如果出现下列情况,会使溶液物质的量浓度如何变化?(填“偏高”、“偏低”或“不变”)
转移时未洗涤烧杯,则结果 ;
所用容量瓶未干燥,则结果 ;
定容时俯视,则结果 。
下列与化学概念有关的说法正确的是
| A.化合反应均为氧化还原反应 |
| B.催化剂能改变可逆反应达到平衡的时间 |
| C.金属氧化物均为碱性氧化物 |
| D.石油是混合物,其分馏产品汽油为纯净物 |
 2Na2O 2Na2O +O2
2Na2O 2Na2O +O2 2Na2O2 。
2Na2O2 。 ,随着CO2的继续通入,活塞又逐渐向右移动。(不考虑活塞的磨擦)
,随着CO2的继续通入,活塞又逐渐向右移动。(不考虑活塞的磨擦)