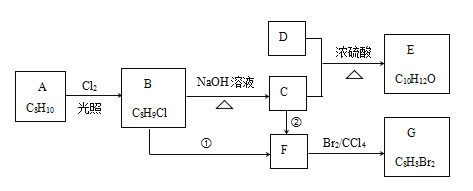
题目内容
【题目】下列物质性质与用途对应关系正确的是
性质 | 用途 | |
A | 硅酸钠化学性质稳定 | 制备木材防火剂 |
B | 硅酸溶胶具有 吸附水分的能力 | 硅作半导体的材料 |
C | 二氧化硅硬度大、熔点高 | 氢氟酸在玻璃上刻花纹 |
D | 焦炭具有可燃性 | 焦炭还原二氧化硅 冶炼粗硅 |
A. AB. BC. CD. D
【答案】A
【解析】
A、硅酸钠的化学性质很稳定,不燃不爆,是制备木材防火剂的原料,选项A正确;
B、硅胶吸附水,与硅作半导体的材料无关,选项B错误;
C、二氧化硅硬度大,与氢氟酸和玻璃反应无关,选项C错误;
D、焦炭具有可燃性,与焦炭还原二氧化硅无关,选项D错误。
答案选A。

 阅读快车系列答案
阅读快车系列答案【题目】催化还原CO2是解决温室效应及能源问题的重要手段之一。研究表明,在Cu/ZnO催化剂存在下,CO2和H2可发生两个反应,分别生成CH3OH和CO。反应的热化学方程式如下:
I.CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)H1=-53.7kJ/mol
CH3OH(g)+H2O(g)H1=-53.7kJ/mol
II.CO2(g)+H2(g)![]() CO(g)+ H2O(g)H2
CO(g)+ H2O(g)H2
某实验控制CO2和H2初始投料比为1:2.2,经过相同反应时间测得如下实验数据:
T(K) | 催化剂 | CO2转化率(%) | 甲醇选择性(%) |
543 | Cat.1 | 12.3 | 42.3 |
543 | Cat.2 | 10.9 | 72.7 |
553 | Cat.1 | 15.3 | 39.1 |
553 | Cat.2 | 12.0 | 71.6 |
[备注]Cat.1:Cu/ZnO纳米棒,Cat.2:Cu/ZnO纳米片;
甲醇选择性:转化的CO2中生成甲醇的百分比。
已知: ①CO和H2的标准燃烧热分别为-283.0kJ/mol和285.8kJ/mol
②H2O(1)![]() H2O(g) H3=+440kJ/mol
H2O(g) H3=+440kJ/mol
请回答(不考虑温度对H的影响):
(1)a.反应II的H2=____kJ/mol。
b.800℃时,反应I和II对应的平衡常数分别为1.0和2.5,则该温度下反应:CO(g)+2H2(g) ![]() CH3OH(g)的平衡常数K的数值为_____。
CH3OH(g)的平衡常数K的数值为_____。
(2)在图中分别画出I在无催化剂、有Cat.1和有Cat.2三种情况下“反应过程-能量”示意图(在图中标注出相应的催化剂) ____。
(3)工业生产甲醇还有如下方法:CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
副反应:2CH3OH(g)![]() CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)
若生产过理中在恒压条件下通入水蒸气,从化学平衡的角度分析该操作对生产甲醇带来的利和弊____。
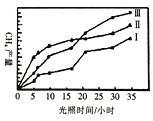
(4)利用光能和光催化剂,可將CO2和H2O(g)转化为CH4和O2。紫外线照射时,在不同催化剂(1、I、III)作用下,CH4产量随光照时间的变化如下图所示。下列说法正确的是____
A.催化剂能加快化学反应速率,在反应开始时对正反应的催化效果更好
B.从图中可知催化剂I的催化效果更好
C.若光照时间足够长,三条由线将相交于一点
D.光照15h前,无论用所给的哪种催化剂,该反应均未达到平衡
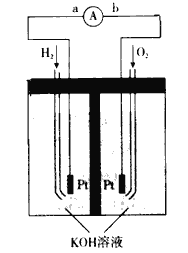
(5)人们正在研究某种锂一空气电池,它是一种环境友好的蓄电池。放电时的总反应为:4Li+O2=2Li2O。在充电时,阳极区发生的过程比较复杂,目前普遍认可是按两步反应进行,请补充完整。
电极反应式:______和Li2O2-2e-=2Li++O2