题目内容
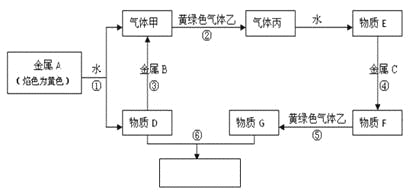
【题目】镍(Ni)有良好的耐高温、耐腐蚀、防锈功能,在电池、催化剂方面有广泛的应用。以硫化镍矿(主要成分为NiS,另含少量CuS,FeS等杂质)为原料制取纯镍的工艺流程如下:
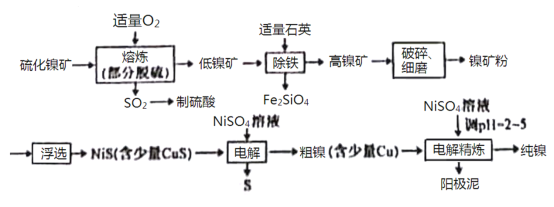
已知物质的还原性:Fe>Ni>H2>Cu。
回答下列问题:
(1)在“熔炼”过程中,二价铁的化合价没有发生改变,则杂质FeS与O2反应的化学方程式为___________________。
(2)高镍矿破碎、细磨的作用是___________________。
(3)在焰色反应实验中,可以用光洁无锈的镍丝代替铂丝蘸取化学试剂灼烧,原因是___________________。
(4)“除铁”过程中,反应的化学反应方程式为___________________。
(5)“电解”制粗镍过程中,阳极发生的主要电极反应为___________________。
(6)“电解精炼”过程中,需调节溶液的pH为2~5,原因是___________________。阳极泥的成分为___________________(写名称)。
【答案】2FeS+3O2![]() 2FeO+2SO2 增大接触面积,提高浮选率 镍在焰色反应中,火焰呈无色,不影响其他金属元素的焰色 SiO2+2FeO
2FeO+2SO2 增大接触面积,提高浮选率 镍在焰色反应中,火焰呈无色,不影响其他金属元素的焰色 SiO2+2FeO![]() Fe2SiO4 NiS-2e-=Ni2++S pH<2时,溶液中c(H+)较大,H+易在阴极放电;pH>5时,Ni2+易形成Ni(OH)2沉淀 铜
Fe2SiO4 NiS-2e-=Ni2++S pH<2时,溶液中c(H+)较大,H+易在阴极放电;pH>5时,Ni2+易形成Ni(OH)2沉淀 铜
【解析】
已知物质的还原性:Fe>Ni>H2>Cu,根据工艺流程分析可知,硫化镍矿在“熔炼”过程中,通入氧气后发生氧化还原反应,生成可用于制取硫酸的SO2,并得到低镍矿,向低镍矿中加入石英发生反应SiO2+2FeO![]() Fe2SiO4,得到高镍矿,再经破碎、细磨后得到镍矿粉进行浮选,进而得到含有少量CuS的NiS,接着在NiSO4作电解质溶液的条件下进行电解,NiS和CuS在阳极失去电子得到S单质和Cu2+、Ni2+,Cu2+、Ni2+再在阴极得到电子得到含有少量Cu的粗镍,最后再在NiSO4溶液中,调节pH至2~5,电解精炼得到纯镍,据此分析解答。
Fe2SiO4,得到高镍矿,再经破碎、细磨后得到镍矿粉进行浮选,进而得到含有少量CuS的NiS,接着在NiSO4作电解质溶液的条件下进行电解,NiS和CuS在阳极失去电子得到S单质和Cu2+、Ni2+,Cu2+、Ni2+再在阴极得到电子得到含有少量Cu的粗镍,最后再在NiSO4溶液中,调节pH至2~5,电解精炼得到纯镍,据此分析解答。
(1)在“熔炼”过程中,二价铁的化合价没有发生改变,高温条件下,杂质FeS与O2反应生成FeO和SO2,反应的化学方程式为2FeS+3O2![]() 2FeO+2SO2,故答案为:2FeS+3O2
2FeO+2SO2,故答案为:2FeS+3O2![]() 2FeO+2SO2;
2FeO+2SO2;
(2)为了提高浮选率,得到较高纯度NiS,可将高镍矿破碎、细磨,增大其接触面积,故答案为:增大接触面积,提高浮选率;
(3)因为镍在焰色反应中,火焰呈无色,不会影响其他金属元素的焰色,所以在焰色反应实验中,可以用光洁无锈的镍丝代替铂丝蘸取化学试剂进行灼烧,故答案为:镍在焰色反应中,火焰呈无色,不影响其他金属元素的焰色;
(4)根据上述分析可知,“除铁”过程中,向低镍矿中加入石英发生反应SiO2+2FeO![]() Fe2SiO4,故答案为:SiO2+2FeO
Fe2SiO4,故答案为:SiO2+2FeO![]() Fe2SiO4;
Fe2SiO4;
(5)“电解”制粗镍过程中,主要是NiS在阳极失去电子得到S单质和Ni2+,发生的主要反应为NiS-2e-=Ni2++S,故答案为:NiS-2e-=Ni2++S;
(6)已知物质的还原性:Fe>Ni>H2>Cu,则氧化性:Cu2+>H+>Ni2+,若当pH<2时,溶液中c(H+)较大,H+易在阴极放电,不易得到Ni单质,pH>5时,Ni2+易形成Ni(OH)2沉淀,“电解精炼”过程中,得到的阳极泥的主要成分为Cu单质,故答案为:pH<2时,溶液中c(H+)较大,H+易在阴极放电;pH>5时,Ni2+易形成Ni(OH)2沉淀;铜。

 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案 激活思维优加课堂系列答案
激活思维优加课堂系列答案【题目】利用如图装置测定中和热的实验步骤如下:

①用量筒量取50 mL0.25mol/L硫酸倒入小烧杯中,测出硫酸温度;
②用另一量筒量取50 mL0.55mol/L NaOH溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液最高温度。
回答下列问题:
(1)大小烧杯中填充泡沫塑料的作用是____。
(2)倒入NaOH溶液的正确操作是___(从下列选出)。
A.一次迅速倒入 B.分三次少量倒入 C.沿玻璃棒缓慢倒入
(3)使硫酸与NaOH溶液混合均匀的正确操作是____。
(4)实验数据如下表:
①请填写下表中的空白:
温度 实验次数 | 起始温度t1℃ | 终止温度t2/℃ | 温度差平均值(t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 29.5 | ___ |
2 | 27.0 | 27.4 | 27.2 | 32.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.2 | |
4 | 26.4 | 26.2 | 26.3 | 29.8 | |
②近似认为0.55mol/L NaOH溶液和0.25mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃)。则中和热ΔH=____( 取小数点后一位)。
③上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是(填字母)____。
a.实验装置保温、隔热效果差
b.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.量取NaOH溶液的体积时仰视读数