题目内容
【题目】亚硫酸钠在印染、造纸等众多行业中有着广泛的应用。研究小组用Na2CO3溶液吸收SO2制备Na2SO3。其实验流程如下:

查阅资料可知,向碳酸钠溶液通入二氧化硫的过程中,溶液中有关组分的质量分数变化如下图是所示。
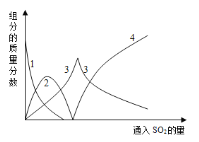
(1)如图中的线2表示的组分为____________(填化学式)
(2)写出如图曲线4的反应方程式:__________________________
(3)实验时,“反应Ⅱ”中加入NaOH溶液的目的是_______________________(用化学方程式表示)
(4)国家标准规定产品中Na2SO3的质量分数≥97.0%为优等品,≥93.0%为一等品。为了确定实验所得产品的等级,研究小组采用了下列方法进行测定。
称取2.570g产品,用蒸馏水溶解,加入足量的双氧水使Na2SO3完全氧化生成Na2SO4,再加入过量的BaCl2溶液,所得沉淀经过滤、洗涤、干燥后称重,质量为4.660g,通过计算确定产品中Na2SO3的质量分数(写出计算过程)。_________________
【答案】NaHCO3 Na2SO3+SO2+H2O ==2NaHSO3 NaHSO3+NaOH=Na2SO3+H2O 98.05%
【解析】
向碳酸钠溶液中通入二氧化硫,发生的反应依次:2Na2CO3+SO2+H2O=2NaHCO3+Na2SO3,2NaHCO3+SO2=Na2SO3+2CO2+H2O, SO2+Na2SO3+H2O=2NaHSO3,所以图像上对应的线1表示Na2CO3,线2表示NaHCO3,线3表示Na2SO3,线4表示NaHSO3,得到亚硫酸钠溶液蒸发浓缩、冷却结晶过滤洗涤得到Na2SO3。
(1)依据反应过程和图象曲线变化可知,曲线2表示的是碳酸氢钠;
(2)曲线4的反应方程式:SO2+Na2SO3+H2O=2NaHSO3;
(3)“反应II”中加入NaOH溶液的目的是和亚硫酸氢钠反应得到亚硫酸钠;
(4)称取2.570g产品,用蒸馏水溶解,加入足量的双氧水使Na2SO3完全氧化生成Na2SO4,再加入过量的BaCl2溶液,所得沉淀经过过滤、洗涤、干燥后称量,质量为4.660g,为硫酸钡沉淀质量,反应为:Na2SO3+H2O2=Na2SO4+H2O,Na2SO4+BaCl2=2NaCl+BaSO4↓,结合硫酸钡物质的量,硫元素守恒计算。
(1)依据反应过程和图象曲线变化可知,曲线2表示的组分为NaHCO3,故答案为:NaHCO3。
(2)依据反应过程和图象曲线变化可知,曲线4表示的组分为NaHSO3,曲线4的反应方程式:SO2+Na2SO3+H2O=2NaHSO3,故答案为:SO2+Na2SO3+H2O=2NaHSO3。
(3)“反应II”中加入NaOH溶液的目的是和亚硫酸氢钠反应得到亚硫酸钠,反应的化学方程式为:NaHSO3+NaOH=Na2SO3+H2O,
故答案为:NaHSO3+NaOH=Na2SO3+H2O。
(4)Na2SO3+H2O2=Na2SO4+H2O,Na2SO4+BaCl2=2NaCl+BaSO4↓,m(BaSO4)=4.660g,n(BaSO4)=4.660g÷233g/mol=0.020mol,则根据硫元素守恒n(Na2SO3)=n(BaSO4)=0.020mol,m(Na2SO3)=0.020mol×126 g/mol=2.520g,w(Na2SO3)=2.520g÷2.570g×100%≈98.05%,故答案为:98.05%。

 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案