题目内容
【题目】已知:pKa=-lgKa, 25℃时,H2A的pKa1=1.85,pKa2=7.19。常温下,用0.1mol·L-1NaOH溶液滴定20 mL0.1mol·L-1H2A溶液的滴定曲线如图所示。下列说法正确的是( )
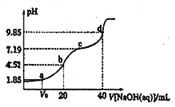
A. a点所得溶液中:c(H2A)>c(HA-) B. b点所得溶液中:c(H2A)+(H+)=c(HA-)+c(OH-)
C. c点所得溶液中:c(A2-)=c(HA-) D. d点所得溶液中A2-水解平衡常数Kh1=10-7.19
【答案】C
【解析】A.根据H2A的pKa1=1.85,所以溶液中c(H2A)=c(HA-),a点溶液中溶质为H2A和NaHA混合物;B. b点酸碱恰好完全反应生成NaHA,溶液显酸性,根据电荷、物料守恒进行处理;C. c点pH=7.19=pKa2,c(A2-)=c(HA-),溶液为NaHA和Na2A混合物;D. A2-水解平衡常数Khl=Kw/Ka2=10-6.81。
用0.1molL-1NaOH溶液滴定20mL0.1molL-1H2A溶液,a点溶液中溶质为H2A和NaHA,pH=1.85=pKa1,则c(H2A)=c(HA-),所加氢氧化钠溶液的体积小于10mL,A错误;b点是用0.1molL-1NaOH溶液滴定20mL0.1molL-1H2A溶液,恰好反应生成NaHA,溶液显酸性,溶液中电荷守恒c(Na+)+c(H+)=c(HA-)+c(OH-)+2c(A2-),物料守恒c(Na+)=c(HA-)+c(A2-)+c(H2A),得到:c(H2A)+c(H+)=c(A2-)+c(OH-),B错误;c点pH=7.19=pKa2,Ka2=c(A2)×c(H+)/c(HA)=10-7.19,所以c(A2-)=c(HA-),C正确;A2-水解平衡常数Khl=Kw/Ka2=10-6.81,D错误;正确选项C。

 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案