题目内容
13.有一句俗语叫“雷雨发庄稼”,其所包含的化学过程有(用化学方程式表示):(1)N2+O2$\frac{\underline{\;放电\;}}{\;}$2NO(2)2NO+O2=2NO2(3)3NO2+H2O=2HNO3+NO.
分析 在放电条件下,氮气跟氧气能直接化合生成无色的一氧化氮气体;一氧化氮不溶于水,在常温下易跟空气中的氧气化合,生成红棕色的二氧化氮气体;二氧化氮易溶于水,它溶于水后生成硝酸和一氧化氮,据此分析解答.
解答 解:“雷雨发庄稼”,空气中的N2在放电条件下与O2直接化合生成无色且不溶于水的一氧化氮气体,N2+O2$\frac{\underline{\;放电\;}}{\;}$2NO;
一氧化氮的密度比空气略大,不稳定,常温下就易与空气中的O2反应生成红棕色的二氧化氮气体,2NO+O2=2NO2;
二氧化氮气体有毒,易与水反应生成硝酸(HN03)和一氧化氮,3NO2+H2O=2HNO3+NO;
生成的硝酸随雨水淋洒到大地上,同土壤中的矿物相互作用,生成可溶于水的硝酸盐可作氮肥,植物生长得更好;
故答案为:N2+O2$\frac{\underline{\;放电\;}}{\;}$2NO;2NO+O2=2NO2;3NO2+H2O=2HNO3+NO;
点评 本题主要考查了氮气、一氧化氮、二氧化氮的化学性质,理解反应原理、正确书写化学方程式是解答的关键,题目难度不大.

练习册系列答案
相关题目
4.设NA为阿佛加德罗常,下列叙述正确的是( )
| A. | 在100mL0.5mol/LCH3COOH溶液中CH3COOH分子数等于0.05NA | |
| B. | 在标况下,22.4L辛烷含共价键数为25NA | |
| C. | 已知PbI2的KSP=7.0×10-9,将1.0×10-2mol/L的KI与Pb(NO3)2溶液等体积混合,则生成PbI2沉淀所需Pb(NO3)2溶液的最小浓度为5.6×10-4 mol/L | |
| D. | 25℃时,1LpH=13的Ba(OH)2溶液中含有OH-数目为0.2NA |
1.相同温度的下列溶液:①0.1mol•L-1的硫酸 ②0.01mol•L-1的NaOH溶液,其中由水电离产生的[H+]之比为( )
| A. | 1:1 | B. | 1:10 | C. | 1:20 | D. | 20:1 |
8.不慎误服BaCl2后,可服用的解毒剂是( )
| A. | CuSO4 | B. | Na2SO4 | C. | AgNO3 | D. | Hg(NO3)2 |
18.下列说法不正确的是( )
| A. | 1mol氧原子 | B. | 1mol 氢分子 | C. | 1mol 苹果 | D. | 1mol水 |
2.砹(At)是卤族元素中位于碘之后的元素,试推测砹和砹的化合物最不可能具有的性质是( )
| A. | 砹易溶于某些有机溶剂 | B. | HAt很不稳定,易分解 | ||
| C. | 砹是有色固体,分子式为At2 | D. | AgAt难溶于水,可溶于稀HNO3 |
3.溶液在25℃时由水电离出氢离子的浓度为1×10-12 mol•L-1,下列说法正确的是( )
| A. | 该溶液pH=12 | B. | 该溶液pH=2 | C. | 该溶液pH=12或2 | D. | 不能确定溶液pH |
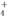 )=c(Cl-)
)=c(Cl-)