题目内容
【题目】短周期主族元素W、X、Y、Z的原子序数依次增大,W、X、Y的原子最外层电子数之和为14;X与Z同族;W是空气中含量最多的元素;Z的单质为常见气体,其水溶液具有漂白性。下列说法正确的是![]()
A.X的最高正化合价为![]()
B.简单离子的半径:![]()
C.Y的单质与冷、热水均不反应
D.W、Z两元素形成的化合物![]() 为共价化合物
为共价化合物
【答案】D
【解析】
W为空气中含量最多的元素,故为N元素;Z的单质为常见气体,其水溶液具有漂白性,则Z为Cl元素;X与Z同族,则X为F元素;W、X、Y的原子最外层电子数之和为14,则Y最外层电子数![]() ,Y的原子序数大于F,则Y为Mg元素,据此解答。
,Y的原子序数大于F,则Y为Mg元素,据此解答。
由分析可知:W为N,X为F,Y为Mg,Z为Cl元素。
A、F元素没有正化合价,故A错误;
B、氮离子、氟离子和镁离子的电子层数相同,其核电荷数越大离子半径越小,则简单离子的半径:![]() ,故B错误;
,故B错误;
C、金属Mg与冷水不反应,但能够与热水反应,故C错误;
D、![]() 为
为![]() ,
,![]() 为共价化合物,故D正确;
为共价化合物,故D正确;
故选:D。

练习册系列答案
 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案
相关题目
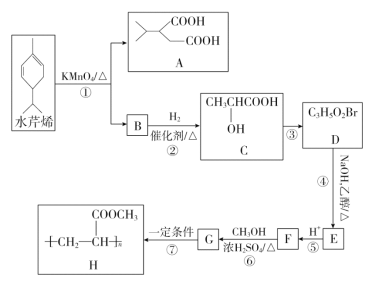
【题目】在300 mL的密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:Ni(s)+4CO(g) ![]() Ni(CO)4(g),已知该反应平衡常数与温度的关系如表所示:
Ni(CO)4(g),已知该反应平衡常数与温度的关系如表所示:
温度/℃ | 25 | 80 | 230 |
平衡常数 | 5×104 | 2 | 1.9×10-5 |
下列说法正确的是( )
A. 上述生成Ni(CO)4(g)的反应为吸热反应
B. 25 ℃时反应Ni(CO)4(g) ![]() Ni(s)+4CO(g)的平衡常数为0.5
Ni(s)+4CO(g)的平衡常数为0.5
C. 在80 ℃时,测得某时刻,Ni(CO)4、CO浓度均0.5 mol/L,则此时v正>v逆
D. 80 ℃达到平衡时,测得n(CO)=0.3 mol,则Ni(CO)4的平衡浓度为2 mol/L