题目内容
将浓度为0.1 mol·L-1 HF溶液加水不断稀释,下列各量始终保持增大的是( )
| A.c(H+) | B.Ka(HF) | C.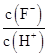 | D.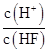 |
D
解析

练习册系列答案
 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案
相关题目
室温下,用0.100 0 mol·L-1NaOH溶液分别滴定体积均为20.00 mL的盐酸和醋酸溶液,滴定曲线如右图。下列说法正确的是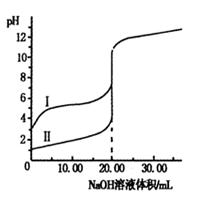
| A.I、Ⅱ分别表示盐酸和醋酸的滴定曲线 |
| B.盐酸和醋酸的浓度均为0.100 0 mol·L-1 |
| C.pH=7时,两种酸所消耗NaOH溶液的体积相等 |
| D.V(NaOH)=20.00mL时,c(Cl一)=c(CH3COO一) |
针对0.1 mol·L-1的醋酸溶液,下列分析判断正确的是( )
| A.升高温度,溶液的pH会增大 |
| B.加入少量固体NaOH,溶液中c(CH3COO-)+c(OH-)>c(Na+)+c(H+) |
| C.加入少量0.2 mol·L-1的硫酸溶液,水电离产生的c(H+)减小 |
| D.与0.1 mol·L-1的NaOH溶液等体积混合后,溶液中c(CH3COO-)=c(Na+) |
将足量BaCO3分别加入:
①30 mL水
②10 mL 0.2 mol/L Na2CO3溶液
③50 mL 0.01 mol/L氯化钡溶液
④100 mL 0.01 mol/L盐酸中溶解至溶液饱和。各溶液中Ba2+的浓度由大到小的顺序为( )
| A.①②③④ | B.③④①② | C.④③①② | D.②①④③ |
以甲基橙为指示剂,用0.10 mol·L-1的盐酸滴定0.10 mol·L-1的氨水,滴定过程中不可能出现的结果是( )
| A.c(NH4+)>c(Cl-),c(OH-)>c(H+) |
| B.c(NH4+)=c(Cl-),c(OH-)=c(H+) |
| C.c(Cl-)>c(NH4+),c(OH-)>c(H+) |
| D.c(Cl-)>c(NH4+),c(H+)>c(OH-) |
25 ℃时,在等体积的①pH=0的硫酸溶液、②0.05 mol/L的Ba(OH)2溶液、③pH=10的Na2S溶液、④pH=5的NH4NO3溶液中,发生电离的水的物质的量之比是( )
| A.1∶10∶1010∶109 | B.1∶5∶5×109∶5×108 |
| C.1∶20∶1010∶109 | D.1∶10∶104∶109 |
已知室温时,0.1 mol/L某一元酸HA在水中有0.1%发生电离,下列叙述错误的是( )
| A.该溶液的pH=4 |
| B.升高温度,溶液的pH增大 |
| C.此酸的电离平衡常数约为1×10-7 |
| D.由HA电离出的c(H+)约为水电离出的c(H+)的106倍 |
化学平衡常数(K)、弱酸的电离平衡常数(Ka)、难溶物的溶度积常数(Ksp)是判断物质性质或变化的重要的平衡常数。下列关于这些常数的说法中,正确的是( )
| A.平衡常数的大小与温度、浓度、压强、催化剂等有关 |
| B.当温度升高时,弱酸的电离平衡常数Ka变小 |
| C.Ksp(AgCl)>Ksp(AgI),由此可以判断AgCl(s)+I-(aq)=AgI(s)+Cl-(aq)能够发生 |
| D.Ka(HCN)<Ka(CH3COOH),说明物质的量浓度相同时,氢氰酸的酸性比醋酸强 |
用水稀释0.1 mol·L-1氨水时,溶液中随水量的增加而减小的是( )。
| A.c(OH-)/c(NH3·H2O) |
| B.c(NH3·H2O)/c(OH-) |
| C.n(OH-)和c(H+) |
| D.c(H+)和c(OH-)的乘积 |