题目内容
【题目】碘化钾可用于有机合成、制药等领域,它是一种白色立方结晶或粉末,易溶于水。有两个学习小组查阅资料后,分别设计以下实验装置制备KI:
【查阅资料】:
(1)3I2+6KOH═KIO3+5KI+3H2O
(2)H2S是有剧毒的酸性气体,具有较强还原性,水溶液称氢硫酸(弱酸);
(3)HCOOH(甲酸)具有强烈刺激性气味的液体,具有较强还原性,弱酸;
(4)在实验条件下,S2-、HCOOH分别被KIO3氧化为SO42-、CO2。
Ⅰ组. H2S还原法,实验装置如图:
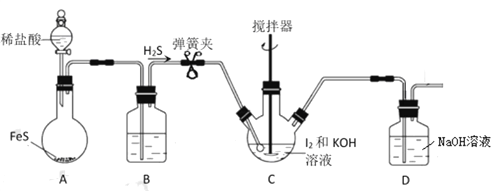
实验步骤如下:
①在上图所示的C中加入127g研细的单质I2和210g 30%的KOH 溶液,搅拌至碘完全溶解。
②打开弹簧夹向其中通入足量的 H2S。
③将装置C中所得溶液用稀H2SO4酸化后,置于水浴上加热10min。
④在装置C的溶液中加入BaCO3,充分搅拌后,过滤、洗涤。
⑤将滤液用氢碘酸酸化,将所得溶液蒸发浓缩,冷却结晶、过滤、洗涤、干燥。得产品145g。
Ⅱ组.甲酸还原法,实验装置如图:
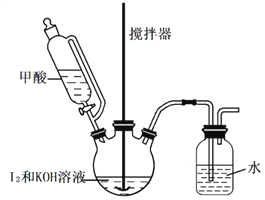
实验步骤如下:
⑥在三颈瓶中加入 127g 研细的单质I2和210g 30%的 KOH 溶液,搅拌至碘完全溶解。
⑦通过滴液漏斗向反应后的溶液中滴加入适量HCOOH,充分反应后,再用KOH溶液调pH至9~10,将所得溶液蒸发浓缩,冷却结晶、过滤、洗涤、干燥。得产品 155g。
回答下列问题;
(1)图中装置 A 中发生反应的离子方程式为__________;装置 B 中的试剂是_________。
(2)D装置的作用是___________。
(3)步骤④的目的是_____________________ 。
(4)步骤⑤中“滤液用氢碘酸酸化”的目的是__________________ 。
(5)Ⅱ组实验的产率为__________________。
(6)Ⅱ组实验中,加入HCOOH发生氧化还原反应的离子方程式为_______________。
(7)与Ⅰ组相比较,Ⅱ组实验的优点是(至少答出两点即可)__________________。
【答案】 FeS + 2H+![]() Fe+ + H2S↑ 饱和NaHS溶液 吸收多余的H2S气体 除去溶液中的SO42- 除去溶液中的CO32- 93.4% 3HCOOH + IO3-
Fe+ + H2S↑ 饱和NaHS溶液 吸收多余的H2S气体 除去溶液中的SO42- 除去溶液中的CO32- 93.4% 3HCOOH + IO3-![]() I- + 3CO2↑+ 3H2O 操作简单、产率高、原料无剧毒等
I- + 3CO2↑+ 3H2O 操作简单、产率高、原料无剧毒等
【解析】Ⅰ组. H2S还原法
试题分析;由题中信息可知,A装置制备硫化氢气体,B用于除去硫化氢中的氯化氢杂质,C是制备碘化钾的装置,D是尾气处理装置。
(1)图中装置 A 中发生反应的离子方程式为FeS + 2H+![]() Fe+ + H2S↑;B用于除去硫化氢中的氯化氢杂质,根据平衡移动原理可知,硫化氢在饱和NaHS溶液中溶解度较小,故装置 B 中的试剂是饱和NaHS溶液。
Fe+ + H2S↑;B用于除去硫化氢中的氯化氢杂质,根据平衡移动原理可知,硫化氢在饱和NaHS溶液中溶解度较小,故装置 B 中的试剂是饱和NaHS溶液。
(2)D装置的作用是吸收多余的H2S气体,防止污染空气。
(3)步骤④中加入BaCO3,可以将溶液中的SO42-转化为难溶于水、难溶于酸的硫酸钡,故其目的是除去溶液中的SO42-。
(4)步骤④中加入BaCO3,在生成硫酸钡的同时,有CO32-生成,故步骤⑤中“滤液用氢碘酸酸化”的目的是除去溶液中的CO32-。
Ⅱ组.甲酸还原法
试题分析:与与Ⅰ组相比较,该实验中没有使用有毒原料、不用除杂、不用进行尾气处理、产品的产率较高。
(5)127g I2的物质的量为0.5mol,210g 30%的 KOH 溶液含KOH的物质的量为1.125mol,由3I2+6KOH═KIO3+5KI+3H2O可知,KOH过量,KIO3被HCOOH还原也生成KI,故理论上0.5mol I2可生成1mol KI(质量为166g),所以,Ⅱ组实验的产率为![]() 93.4%。
93.4%。
(6)Ⅱ组实验中,加入HCOOH发生氧化还原反应的离子方程式为3HCOOH + IO3-![]() I- + 3CO2↑+ 3H2O。
I- + 3CO2↑+ 3H2O。
(7)与Ⅰ组相比较,Ⅱ组实验的优点是操作简单、产率高、原料无剧毒等。

【题目】X、Y、Z、W为按原子序数由小到大排列的四种短周期元素,已知:
①X元素原子价电子排布式为ns2np2 , 且原子半径是同族元素中最小的.
②Y元素是地壳中含量最多的元素;W元素的电负性略小于Y元素,在W原子的电子排布中,p轨道上只有1个未成对电子.
③Z元素的电离能数据见表(kJ/mol):
I1 | I2 | I3 | I4 | … |
496 | 4562 | 6912 | 9540 | … |
请回答:
(1)Z2Y2的电子式为 , 含有的化学键类型 , Z2Y2为晶体.
(2)X、Y、Z三种元素所形成的常见化合物的名称为;XY2的结构式为 , 分子立体构型为 .
(3)X、Y、Z、W四种元素所形成的单质中,熔点最高、硬度最大的是(填名称);晶体ZW的熔点比晶体XW4明显高的原因是 .