题目内容
【题目】(1)下列物质N2、H2O、Na2O2、CaCl2、KOH、NaF中,既含有离子键,又含有共价键的物质是_______,属于共价化合物的是__________。
(2)用电子式表示CaCl2的形成过程: __________。
(3)氮化钠(Na3N)是科学家制备的种重要化合物,它与水作用产生NH3。请写出Na3N的电子式是__________。
(4)Na3N与盐酸反应生成两种盐,反应的化学方程式为___________。
【答案】 Na2O2、KOH H2O 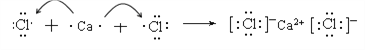
![]() Na3N+4HCl=3NaCl+NH4Cl
Na3N+4HCl=3NaCl+NH4Cl
【解析】分析:(1)一般活泼的金属和活泼的非金属容易形成离子键,非金属元素的原子间容易形成共价键。全部由共价键形成的化合物是共价化合物;
(2)氯化钙是离子化合物,据此书写其形成过程;
(3)根据氮化钠是离子化合物书写电子式;
(4)根据原子守恒判断生成物,书写化学方程式。
详解:(1)N2中含有共价键,H2O中含有共价键,Na2O2中含有离子键和共价键,CaCl2中含有离子键,KOH中含有离子键和共价键,NaF中含有离子键,因此既含有离子键,又含有共价键的物质是Na2O2、KOH,属于共价化合物的是H2O。
(2)氯化钙是离子化合物,含有离子键,则用电子式表示CaCl2的形成过程为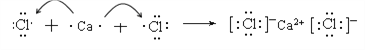 。
。
(3)氮化钠(Na3N)与水作用产生NH3,这说明氮化钠是离子化合物,则Na3N的电子式是![]() 。
。
(4)Na3N与盐酸反应生成两种盐,根据原子守恒可知应该是氯化钠和氯化铵,因此反应的化学方程式为Na3N+4HCl=3NaCl+NH4Cl。

 华东师大版一课一练系列答案
华东师大版一课一练系列答案【题目】下表是25 ℃时某些弱酸的电离平衡常数。
化学式 | CH3COOH | HClO | H2CO3 | H2C2O4 |
Ka | Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.1×10-7 Ka2=5.6×10-11 | Ka1=5.9×10-2 Ka2=6.4×10-5 |
(1)H2C2O4与含等物质的量的KOH的溶液反应后所得溶液呈酸性,该溶液中各离子浓度由大到小的顺序为__________。
(2)pH相同的NaClO和CH3COOK溶液,其溶液的物质的量浓度的大小关系是CH3COOK________NaClO,两溶液中:[c(Na+)-c(ClO-)]________[c(K+)-c(CH3COO-)](填“>”“<”或“=”)。
(3)向0.1 mol·L-1 CH3COOH溶液中滴加NaOH溶液至c(CH3COOH)∶c(CH3COO-)=5∶9,此时溶液pH=________。
(4)取10 mLpH=2的CH3COOH溶液,加入少量无水醋酸钠固体(假设加入固体前后溶液体积保持不变),待固体溶解后,溶液中![]() 的比值将________(填“增大”“减小”或“无法确定”)。
的比值将________(填“增大”“减小”或“无法确定”)。
(5)向碳酸钠溶液中滴加少量氯水的离子方程式为____________________。